Elektrophile Addition
Die Elektrophile Addition (AE) ist eine chemische Reaktion in der Organischen Chemie, bei der ungesättigte Kohlenwasserstoffe (Alkene oder Alkine) mit verschiedenen Stoffklassen reagieren. Gemeinsames Merkmal elektrophiler Additionen ist, dass die Reaktion durch den Angriff eines elektronenliebenden Teilchens, des Elektrophils, an die Doppel- oder Dreifachbindung eingeleitet wird, genauer an die π-Bindung.
Inhaltsverzeichnis
1 Addition an die C=C-Doppelbindung
1.1 Addition von Halogenen an Alkene
1.2 Addition von Halogenwasserstoffen
2 Alkohole aus Alkenen
2.1 Addition von Wasser an Alkene
2.2 Synthese von Diolen
3 Addition an konjugierte Doppelbindung
4 Addition an Alkine
5 Addition an Carbonyle
6 Literatur
7 Weblinks
Addition an die C=C-Doppelbindung |
Addition von Halogenen an Alkene |

Addition von Brom an ein Alken
Molekulare Halogene können in einem zweistufigen Mechanismus an die Doppelbindung von Alkenen addiert werden. Das Halogenmolekül tritt hierbei in Wechselwirkung mit der Doppelbindung des Alkens, wodurch das Halogenmolekül polarisiert wird und sich die Elektronenbindung heterolytisch spaltet. Im ersten Schritt erfolgt die Addition eines Haloniumions (hier als Beispiel: eines Bromoniumions (Br+)) an die Doppelbindung des Kohlenstoffatoms, bei der es unter Aufspaltung der Doppelbindung ein kurzlebiges cyclisches Kation bildet. Im zweiten Schritt greift das Halogenidion (hier: Bromidion) nukleophil am positivierten Kohlenstoffatom an, wodurch das gesättigte α,β-dihalogenierte Produkt erhalten wird.
Die Addition von Halogenen ist auf die Elemente Chlor, Brom und Iod beschränkt. Molekulares Fluor hingegen ist hochreaktiv und würde unselektiv C-C- und C-H- Bindungen angreifen. Chlor ist elektronegativer und schlechter polarisierbar als Brom und Iod. Aus diesem Grund verläuft die Addition von Chlor über eine carbokationische Zwischenstufe, die nicht durch die Ausbildung einer cyclischen (nicht existenten) Chloroniumsstruktur stabilisiert ist.

Anti-Addition von Brom an ein Alken
Die Ausbildung von stabilisierten Kationen, wie sie für die Addition von Brom und Iod auftritt, bestimmt auch die Stereochemie des gebildeten Dihalogenids. Hierdurch wird eine Seite des Moleküls effektiv für nukleophile Angriffe abgeschirmt, sodass der Angriff nur noch von der gegenüberliegenden Seite stattfinden kann. Man spricht hierbei von einer anti-Addition. Dies führt dazu, dass bei der Addition von Brom und Iod mit hoher Selektivität das anti-Produkt gebildet wird.

Addition von Halogenwasserstoffen |
Auch Halogenwasserstoffsäuren können an Alkene addiert werden, wodurch Halogenalkane gebildet werden. Diese Addition verläuft ebenfalls zweistufig. Im ersten Schritt addiert das Proton der eingesetzten Säure an die Doppelbindung. Im Gegensatz zu Haloniumionen besitzt das Proton nicht die Fähigkeit die positive Ladung zu stabilisieren, weshalb ein Carbokation gebildet wird. An dieses addiert nun im zweiten Schritt das Anion der Säure.
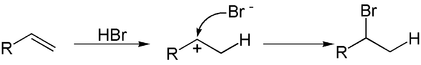
Bei dieser Addition können zwei verschiedene Produkte gebildet werden, die sich in der Position des Halogens unterscheiden. Welches der Produkte bevorzugt gebildet wird, hängt von der Stabilisierung des intermediären Carbokations ab und wird durch die Markownikow-Regel beschrieben, die besagt, dass das Wasserstoffatom immer an das bereits wasserstoffreichere Kohlenstoffatom gebunden wird. Bevorzugt wird das Produkt gebildet, das ein besser stabilisiertes Carbokation besitzt. In der Regel ist das stabilere Carbokation das höher alkylierte. Je nach Edukt können bei dieser Reaktion hohe Regioselektivitäten erzielt werden.
Alkohole aus Alkenen |
Addition von Wasser an Alkene |
Wasser ist ein schlechtes Nukleophil, weshalb die Umsetzung von Alkenen mit Wasser meist nicht zu dem erwarteten Reaktionsprodukt, einem Alkohol, führt. Die Reaktion läuft jedoch unter Säurekatalyse ab. Wie zuvor beschrieben addiert sich hier im ersten Schritt ein Proton der Säure an die Doppelbindung. Das gebildete Carbokation ist nun ausreichend elektrophil für den nukleophilen Angriff eines Wassermoleküls. Dieses spaltet nach der Addition ein Proton ab, wodurch ein sekundärer Alkohol entsteht.

Ist das Anion der Säure selbst ein Nukleophil, so tritt das Anion in Konkurrenz zu Wasser um die Addition an das Carbokation (siehe auch voriger Abschnitt).
Synthese von Diolen |
Die Addition von Wasser an Doppelbindungen liefert Alkohole, Diole können auf diesem Weg jedoch nicht synthetisiert werden. Diese sind durch die Addition von anorganischen Sauerstoffverbindungen, beispielsweise Kaliumpermanganat oder Osmiumtetroxid möglich. Im ersten Schritt addiert hier der Sauerstoffüberträger an das Alken, im zweiten Schritt wird das entstandene Zwischenprodukt hydrolysiert wodurch das Diol freigesetzt wird.

Unter anderem für die Entwicklung einer stereoselektiven Dihydroxylierung wurde 2001 der Nobelpreis für Chemie an Barry Sharpless verliehen.
→ siehe auch Hauptartikel: Dihydroxylierung
Addition an konjugierte Doppelbindung |
Die Addition an konjugierte Doppelbindungen folgt den gleichen Regeln wie die zuvor beschriebene Addition an isolierte Doppelbindungen. Jedoch ist zu berücksichtigen, dass das im ersten Schritt gebildete Carbokation mesomer stabilisiert werden kann. Diese Stabilisierung verteilt die positive Ladung auf mehrere Kohlenstoffatome, wodurch das Nukleophil an verschiedenen Positionen angreifen kann. Meist wird bei solchen Reaktionen ein Gemisch aus beiden Produkten erhalten.

Addition an Alkine |
Analog der Addition an Alkene können auch Additionen an die Dreifachbindung von Alkinen durchgeführt werden. Mechanistisch laufen diese analog zu der Addition an Alkenen ab. Im ersten Schritt greift ein Elektrophil an der Dreifachbindung an, wodurch ein Vinylkation entsteht. Im zweiten Schritt greift dann ein vorhandenes Nukleophil an der kationischen Position an. Hierbei entsteht ein substituiertes Alken. Diese kann in einer zweiten Additionsreaktion zum entsprechenden Alkan weiterreagieren.
Wurden durch die erste Addition elektronenziehende Gruppen wie Halogenatome eingeführt, so verläuft die zweite Addition deutlich langsamer, da die Elektronendichte der Doppelbindung vermindert ist. Die Reaktion kann so oftmals nach der ersten Addition auf Stufe des Alkens angehalten werden.


Keto-Enol-Tautomerie von Phloroglucin
Die säurekatalysierte Addition von Wasser an Alkine liefert Enole. Diese tautomerisieren zu Ketonen (Keto-Enol-Tautomerie), weshalb die Addition von Wasser an Alkine eine Möglichkeit zur Synthese von Ketonen ist.
Addition an Carbonyle |
Auch an Carbonylgruppen können Additionsreaktionen durchgeführt werden. Im Unterschied zur Addition an C-C-Bindungen ist die C-O-Bindung durch die im Vergleich zum Kohlenstoff höhere Elektronegativität stets polarisiert. Nukleophile greifen somit stets am elektronenarmen Kohlenstoffatom an, Elektrophile reagieren folglich mit dem Sauerstoffatom.
Ein Beispiel für eine elektrophile Addition an eine Carbonylgruppe ist die Bildung von Acetalen aus Ketonen oder Aldehyden. Im ersten Schritt wird hierbei der Carbonylsauerstoff mittels einer Säure protoniert. Hierdurch entsteht eine positive Ladung am Carbonylkohlenstoff, an den im zweiten Schritt ein Alkohol nukleophil angreift. Durch Abspaltung des Protons am vormaligen Alkohol wird das Halbacetal freigesetzt.
Literatur |
- Peter Sykes: Wie funktionieren organische Reaktionen? 2. Auflage, Wiley-VCH 2001, ISBN 3-527-30305-7
- Marye Anne Fox/James K. Whitesell: Organische Chemie, Grundlagen, Mechanismen, bioorganische Anwendungen, Spektrum, Akad. Verl., 1995, ISBN 3-86025-249-6
Weblinks |
- Elektrophile Addition – Erklärungen, Beispiele, Video
Chempage: Elektrophile Addition – gute Erklärung


