Nitrile
Allgemeine Formel eines Nitrils, die funktionelle Gruppe ist blau markiert. Der Rest R ist ein Organyl-Rest (Alkyl-Rest, Aryl-Rest, Alkylaryl-Rest etc.). oder – seltener – ein Acyl-Rest.
Nitrile sind eine Gruppe chemischer Verbindungen mit der allgemeinen Formel R–C≡N. Die funktionelle Gruppe aus Kohlenstoff und dreifach gebundenem Stickstoff wird als Nitril- oder Cyanogruppe bezeichnet.[1] Die Nitrile leiten sich formal von der Blausäure (HCN) durch Austausch des Wasserstoffatoms gegen einen organischen Rest ab. Die Isomere mit der Formel R–N≡C nennt man Isonitrile.
Nitril-Polymere sind chemisch sehr beständig und haben gummiähnliche Eigenschaften, weshalb sie z. B. für Schutzhandschuhe verwendet werden.
Inhaltsverzeichnis
1 Nomenklatur
2 Herstellung
3 Reaktionen
4 Verwendung
5 Siehe auch
6 Einzelnachweise
Nomenklatur |
Butyronitril,
nach IUPAC: Butannitril (blau markiertes C-Atom zählt zur Hauptkette),
formal auch Propancarbonitril (blau markiertes C-Atom zählt zum Substituenten)
Ist das Nitril die funktionelle Gruppe höchster Rangordnung, so wird die Endung "-nitril" an den Namen der Ausgangsverbindung angehängt, die Benennung erfolgt als „Alkannitril“. Das dreifach gebundene Kohlenstoffatom wird, wie immer, für die Benennung des Grundgerüsts mitgezählt.[2] Alternativ kann (analog zu -carbonsäure), die Endung "-carbonitril" verwendet werden, hier wird das Kohlenstoffatom nicht zum Grundgerüst gezählt.[3]
Ist die Nitrilfunktion nicht von höchster Rangordnung im Molekül, so wird die Vorsilbe „Cyan-“ mit entsprechender Positionsbezeichnung verwendet. Auch hier wird das dreifach gebundene Kohlenstoffatom nicht zum Grundgerüst gezählt.
Entsprechend ihrer Verwandtschaft mit den Carbonsäuren (der Nitrilkohlenstoff hat die gleiche Oxidationsstufe wie der Carboxylkohlenstoff) werden viele Nitrile trivial als „Carboxylonitrile“ bezeichnet, beispielsweise Acetonitril, Propionitril, Butyronitril oder Mandelonitril.
Herstellung |
Industriell werden Nitrile durch Hydrocyanierung (Addition von HCN an Alkene) und durch katalytische Oxidation von Alkenen und Ammoniak mit Luft hergestellt.
Im Labormaßstab können Nitrile durch Umsetzung von Alkalicyaniden (Alkalimetall-Salze der Blausäure) mit Alkylhalogeniden hergestellt werden (Kolbe-Nitrilsynthese). Dabei entsteht das Alkannitril und ein Alkalihalogenid. Als Nebenprodukte treten Isonitrile auf. Die Umsetzung von Methyliodid mit Natriumcyanid zu Acetonitril und Natriumiodid sei als Beispiel für diese Reaktion gegeben:
- CH3I+NaCN⟶CH3CN+NaI{displaystyle mathrm {CH_{3}I+NaCNlongrightarrow CH_{3}CN+NaI} }
Weitere Möglichkeiten sind die Dehydratisierung von Aldoximen mit z. B. Phosphorpentachlorid, PCl5, analog einer Beckmann-Umlagerung oder die Umsetzung von Metallthiocyanaten mit Carbonsäuren bekannt als Letts-Nitrilsynthese.

Herstellung von Arylnitrilen ausgehend von Chinonen durch reduktive Aromatisierung silylierter Cyanohydrin-Zwischenstufen
Die Herstellung von Arylnitrilen gelingt durch die
Sandmeyer-Reaktion (Diazotierung von Anilin-Derivaten und Reaktion mit Kupfer(I)-cyanid)
Rosenmund-von Braun-Reaktion (direkte Umsetzung eines Arylbromids mit Kupfer(I)-cyanid)- Reduktive Aromatisierung von silylierten Cyanohydrinen (Umsetzung von Chinonen mit Trimethylsilylcyanid und anschließende Aromatisierung mit PBr3)[4]
Reaktionen |
Durch Hydrolyse von Nitrilen kann man Carbonsäuren herstellen.
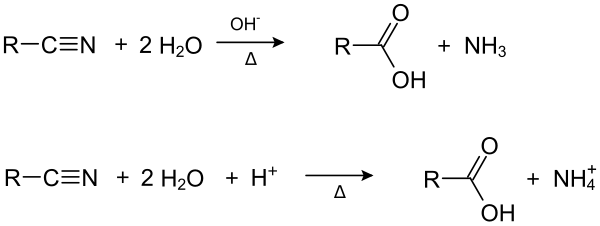
Des Weiteren kann man durch Reduktion (Hydrierung) eines Nitrils ein Amin herstellen.

Verwendung |

Ein Nitril-Handschuh, wie er in der Medizin verwendet wird
Besonders Adiponitril und Acrylnitril sind als Zwischenprodukte der Kunststoffherstellung von praktischer Bedeutung.
Eine wichtige Bedeutung von Nitrilen liegt darin, dass man in einer chemischen Synthese diese Gruppe leicht einführen und dann in andere funktionelle Gruppen (Aminosäuren oder Amine) umwandeln kann. Das Verfahren zur Herstellung von α-Aminosäuren aus Aldehyden, bei der Nitrile als Zwischenprodukte auftreten, ist als Strecker-Synthese bekannt.
Acetonitril findet als Lösungsmittel Verwendung.
Bei medizinischen Untersuchungshandschuhen sind solche aus Nitrilkautschuk aufgrund der fehlenden Allergiegefahr denen aus Latex überlegen. Als Material für Schutzhandschuhe besticht besonders die gute chemische Beständigkeit.
Siehe auch |
Isonitrile, R–N≡C, sind Isomere der Nitrile und finden als Edukte in Mehrkomponenten-Reaktionen (Passerini-Reaktion, Ugi-Reaktion) Anwendung.
Einzelnachweise |
↑ Hans Beyer und Wolfgang Walter: Organische Chemie, S. Hirzel Verlag, Stuttgart, 22. Auflage, 1991, ISBN 3-7776-0485-2, S. 266–269.
↑ Eintrag zu nitriles. In: IUPAC Compendium of Chemical Terminology (the “Gold Book”). doi:10.1351/goldbook.N04151 Version: 2.3.3.
↑ Eintrag zu carbonitriles. In: IUPAC Compendium of Chemical Terminology (the “Gold Book”). doi:10.1351/goldbook.C00838 Version: 2.3.3.
↑ Florian Glöcklhofer, Markus Lunzer, Johannes Fröhlich: Facile Synthesis of Cyanoarenes from Quinones by Reductive Aromatization of Cyanohydrin Intermediates. In: Synlett. Band 26, Nr. 07, 1. April 2015, S. 950–952, doi:10.1055/s-0034-1380150.

