Phenol
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Phenol | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
Summenformel | C6H6O | ||||||||||||||||||
| Kurzbeschreibung | farblose nadelförmige Kristalle mit durchdringendem Geruch[2] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Arzneistoffangaben | |||||||||||||||||||
ATC-Code |
| ||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
Molare Masse | 94,11 g·mol−1 | ||||||||||||||||||
Aggregatzustand | fest | ||||||||||||||||||
Dichte | 1,07 g·cm−3[2] | ||||||||||||||||||
Schmelzpunkt | 41 °C[2] | ||||||||||||||||||
Siedepunkt | 182 °C[2] | ||||||||||||||||||
Dampfdruck | 0,2 hPa (20 °C)[3] | ||||||||||||||||||
pKs-Wert | 9,99[4] | ||||||||||||||||||
Löslichkeit | mäßig in Wasser (84 g·l−1 bei 20 °C)[2] | ||||||||||||||||||
Brechungsindex | 1,5408 (41 °C)[5] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
MAK |
| ||||||||||||||||||
Toxikologische Daten |
| ||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | |||||||||||||||||||
Phenol (nach IUPAC: Benzenol, veraltet: Karbolsäure oder kurz Karbol) ist eine aromatische, organische Verbindung und besteht aus einer Phenylgruppe (–C6H5), an die eine Hydroxygruppe (–OH) gebunden ist. Der farblose, kristalline Feststoff ist eine wichtige Industriechemikalie und dient als Zwischenprodukt besonders zur Herstellung diverser Kunststoffe. Phenol ist der einfachste Vertreter der Phenole. Mit Basen bildet Phenol Salze, die Phenolate.
Inhaltsverzeichnis
1 Geschichte
2 Darstellung
3 Eigenschaften
3.1 Physikalische Eigenschaften
3.2 Chemische Eigenschaften
4 Verwendung
5 Sicherheitshinweise
6 Historische Beschreibung
7 Weblinks
8 Einzelnachweise
Geschichte |
Phenol wurde im Jahr 1834 vom Chemiker Friedlieb Ferdinand Runge bei der Destillation von Steinkohlenteer entdeckt; er bezeichnete die Substanz als „Carbolsäure“. Auguste Laurent entdeckte sie 1841 erneut und ermittelte die Summenformel als C6H6O. Charles Gerhardt nannte sie Phenol.[11] Der Name weist auf das Leuchtgas hin, welches neben Steinkohlenteer bei der Produktion von Koks entstand. Leuchtgas (Stadtgas) diente damals zur Beleuchtung der Städte (gr. phainomai: leuchten).
Sir Joseph Lister setzte es 1865 – in fünfprozentiger Lösung – als Antiseptikum bei der Wunddesinfektion ein; damals war die Carbolsäure nahezu das einzig verfügbare Mittel gegen Wundinfektionen.[3] Wegen seiner hautirritierenden Nebenwirkung wurde es aber bald durch andere Antiseptika ersetzt. Wegen seiner bakteriziden Wirkung wurde es als Desinfektionsmittel eingesetzt und wird heute durch Derivate des Phenols ersetzt.[12]
Phenol wird zusammen mit Formaldehyd zur Herstellung der Phenoplast-Kunstharze verwendet: Unter dem Warenzeichen Bakelit wurde Phenolharz zu Beginn des 20. Jahrhunderts als erster vollsynthetischer, industriell produzierter Kunststoff hergestellt.
Während des Zweiten Weltkriegs ermordeten SS-Ärzte KZ-Häftlinge u. a. durch intrakardiale Phenolinjektionen.[13][14][15]
Darstellung |
Phenole sind nicht durch elektrophile aromatische Substitution darzustellen, da ein entsprechendes Sauerstoff-Elektrophil nicht zugänglich ist.
Im industriellen Maßstab wird die Grundchemikalie Phenol durch das Cumolhydroperoxid-Verfahren, auch als Phenolsynthese nach Hock (Hock-Verfahren) bekannt, hergestellt:

Benzol und Propen werden zunächst durch eine Friedel-Crafts-Alkylierung im Sauren in Isopropylbenzol (Cumol) überführt. Cumol wird durch Luftsauerstoff zum Hydroperoxid oxidiert, welches durch saure Aufarbeitung unter Umlagerung zu Phenol und Aceton zerfällt.[3] Das gleichzeitige Entstehen zweier leicht trennbarer, wertvoller Produkte macht dieses Verfahren besonders wirtschaftlich.
Im Labormaßstab werden Phenole auch durch Verkochen von Diazoniumsalzen, welche durch die Diazotierung von aromatischen Aminoverbindungen – hier von Anilin – mit Salpetriger Säure in der Kälte entstehen, hergestellt:
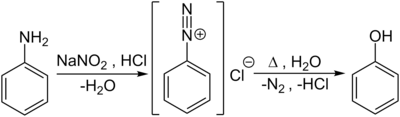
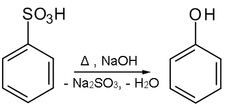
Eine weitere Darstellungsmöglichkeit besteht im Zusammenschmelzen des Natriumsalzes der Benzolsulfonsäure mit Alkalihydroxid in einer nucleophilen aromatischen Substitution nach Additions-Eliminierungs-Mechanismus (ipso-Substitution):
Im Sinne einer radikalischen Substitution kann Benzol in der Fenton-Reaktion zu Phenol umgesetzt werden. Die Baeyer-Villiger-Oxidation von Acetophenon liefert Essigsäurephenylester, welches nach Verseifung Phenol freisetzt.
Eigenschaften |

Phenol
Physikalische Eigenschaften |
Reines Phenol bildet bei Zimmertemperatur farblose Kristallnadeln, jedoch ist das kommerziell erhältliche Produkt i. d. R. durch geringe, aber intensiv gefärbte Verunreinigungen rosa bis rötlich-braun gefärbt.[16] Der Schmelzpunkt liegt bei 41 °C und der Siedepunkt bei 182 °C. Es besitzt einen charakteristischen, aromatischen Geruch. Wegen der hydrophilen OH-Gruppe ist Phenol hygroskopisch. In Phenol löst sich begrenzt viel Wasser. Bei etwa 6 % Wasser ist das Gemisch bei 20 °C flüssig.[3] Phenol löst sich nur mäßig in Wasser. Zwischen den Lösungen mit hohem und niedrigem Phenolanteil besteht eine Mischungslücke.[17] Mit Wasser verflüssigtes Phenol wurde im medizinischen Bereich als Phenolum liquefactum bezeichnet.[18]
Chemische Eigenschaften |
Die Hydroxygruppe des Phenols reagiert im Vergleich zu Alkoholen stärker sauer; daher ist Phenol eine schwache organische Säure. Die Ursache ist die Mesomeriestabilisierung der korrespondierenden Base des Phenolations. Die negative Ladung kann in den Ring delokalisiert werden.
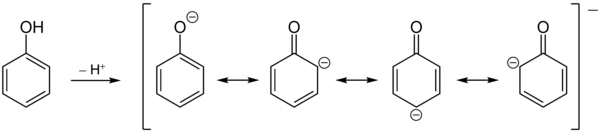
Im Gegensatz zu Alkoholen gehen Phenole nur bei hohen Temperaturen und Anwesenheit spezieller Katalysatoren nukleophile Substitutionsreaktionen unter Ersatz der Hydroxygruppe durch andere Nukleophile ein.[19] Die Hydroxy-Funktion zeigt, besonders im deprotonierten Zustand, einen ausgeprägten +M-Effekt. Daneben zeigt sie einen −I-Effekt. Da dieser aber deutlich kleiner ist als der +M-Effekt, wird Phenol sehr leicht elektrophil angegriffen. Der Angriff erfolgt bevorzugt in ortho- und para-Position zur Hydroxygruppe. Wegen des elektronenschiebenden Charakters der Hydroxygruppe ist Phenol etwa tausendmal reaktiver als Benzol.
Die Bevorzugung des ortho- bzw. para-Angriffs von Elektrophilen lässt sich durch Betrachtung der Grenzstrukturen des Phenolat-Anions verstehen. Die negative Ladung wird in den aromatischen Ring auf die ortho- und para-Positionen delokalisiert. Da Elektrophile bevorzugt elektronenreiche Positionen angreifen, kommt es zu der beobachteten Regioselektivität. Die Substitution in para-Position ist zusätzlich bevorzugt, da es dort nicht zu sterischen Wechselwirkungen des angreifenden Elektrophils mit den freien Elektronenpaaren des Sauerstoffs kommt.
Die Keto-Enol-Tautomerie liegt wegen der Ausbildung des thermodynamisch günstigen aromatischen Systems vollständig auf der Enol-Seite.
Eine technisch bedeutende nukleophile Substitutionsreaktion ist die Darstellung von Anilin aus Phenol bei 250 °C und Anwesenheit eines Oxid-Katalysators (Aluminium-, Silicium- oder Magnesiumoxid, auch Borsäure) als „Halcon-Prozess“.[20]
- C6H5OH + NH3 →Kat.250∘C C6H5NH2 + H2O{displaystyle mathrm {C_{6}H_{5}OH + NH_{3} {xrightarrow[{Kat.}]{250^{circ }C}} C_{6}H_{5}NH_{2} + H_{2}O} }
Phenol setzt sich durch katalytische Hydrierung zu Cyclohexanol um.
Verwendung |

Phenoplaste sind Polykondensate aus Phenolen und Formaldehyd. Sie sind die ersten, synthetisch hergestellten Kunststoffe und wurden ursprünglich unter dem Namen Bakelit vertrieben. Phenol (1) reagiert mit Formaldehyd (2) und einem weiteren Phenolmolekül zum Dimer (4); als saurer Katalysator wird hier Chlorwasserstoff (3) eingesetzt, Wasser wird frei (3). Das Dimer wird mit weiterem Phenol und Formaldehyd zum Kunststoff umgesetzt.
Phenol wird hauptsächlich als Ausgangsstoff zur Herstellung von Kunststoffen verwendet. Dabei spielt die Herstellung von Phenoplasten die wichtigste Rolle. Phenol wird auch zu Caprolactam umgesetzt, einem Stoff zur Herstellung von Polyamiden. Die Umsetzung zu Bisphenol A liefert einen wichtigen Ausgangsstoff zur Herstellung von Epoxidharzen.
Aus Phenol wird das Arzneimittel Acetylsalicylsäure hergestellt. In der Mikroskopie wird Phenol zur Konservierung und zur Gram-Färbung verwendet.
Sicherheitshinweise |
Phenol wirkt sowohl lokal als auch systemisch stark toxisch; bei dermaler Exposition besitzt es eine reizende bis ätzende Wirkung auf Schleimhäute, Haut und Augen. Die Augen können Schäden in Form einer Trübung der Hornhaut, Schwellungen und Verwachsung der Lider bis zur Erblindung erleiden. Hautkontakt führt zuerst zu Hautrötung, später zu einer Weißverfärbung; längere Einwirkungszeit verursacht eine Dunkelfärbung bis zur Bildung von Nekrosen.[2]
Phenol wird vorwiegend über die Haut resorbiert, aber auch inhalative oder orale Aufnahme ist möglich. Im menschlichen Organismus schädigt die Substanz akut Nieren, Blut, Zentralnerven- und Herz-Kreislauf-System. Bei chronischer Exposition sind auch gastrointestinale und nervale Störungen, weiterhin Schädigung von Leber, Nieren und Hautveränderungen bekannt. Bei Inhalation wurden als Vergiftungssymptome Schwindel, Kopfschmerz und Störungen der Ohren, Erbrechen, Schlaflosigkeit und Nierenreizung beschrieben. Die Aufnahme hoher Mengen führte innerhalb weniger Stunden zu massiven Nierenfunktionsstörungen bis zu akutem Nierenversagen. Orale Aufnahme bewirkt Verätzungen im Mund, Rachen, Speiseröhre und Magen; weiterhin sind Schluckstörungen und Störungen im Magen-Darm-Trakt bekannt.[2]
Die Toxizität wird auf reaktive Metaboliten des Phenol zurückgeführt, die an die DNA und andere Makromoleküle binden und dabei Brüche in den Chromosomen und mutagene Effekte auslösen können. Eine orale Dosis ab 1 g kann vereinzelt für einen Menschen tödlich sein; individuell wurden aber auch wesentlich höhere Dosen überlebt.[2] Der orale LDLo-Wert für den Menschen liegt zwischen 140[10] und 1400 mg/kg Körpergewicht; bei Kindern beträgt die orale minimale letale Dosis 10 mg/kg Körpergewicht.[9][2]
Die Auswirkungen von Phenol auf die menschliche Gesundheit und die Umwelt wurden unter REACH im Jahr 2015 im Rahmen der Stoffbewertung von Dänemark geprüft. Es steht unter dem Verdacht, mutagen zu sein.[21]
Historische Beschreibung |
„Karbolsäure (Steinkohlenteerkreosot, acidum phenylicum, acidum carbolicum). Eine Substanz, die für die Farbenindustrie und Medizin (als Desinfektionsmittel) eine außerordentliche Bedeutung erlangt hat. Der Handelsname ist immer noch Karbolsäure, während der wissenschaftliche Name jetzt Phenol ist; diese Substanz besitzt zwar die Eigenschaften einer schwachen Säure und ist imstande, sich mit Basen zu verbinden, wird deshalb auch Phenylsäure oder Phensäure genannt, zugleich aber und in noch höherem Grade spielt sie die Rolle eines Alkohols, daher auch der Name Phenylalkohol, den man in Phenol gekürzt hat. Man gewinnt die Karbolsäure hauptsächlich aus dem Steinkohlenteer und dem Braunkohlenteer, im Holzteer sind nur äußerst geringe Mengen davon enthalten, denn das Kreosot des Holzteers besteht nicht, wie man eine Zeit lang glaubte, aus Phenol, sondern aus dem strukturell ähnlichen Kresol, sowie noch einigen anderen Stoffen. Um die Karbolsäure zu gewinnen, behandelt man den zwischen 150 und 200 °C übergehenden Teil des Teers mit Natronlauge, welche sich mit der Karbolsäure und dem Kresol, das auch im Steinkohlenteer enthalten ist, verbindet, trennt diese Lösung von den übrigen Teerbestandteilen und zersetzt sie mit einer Säure. Man destilliert dann das abgeschiedene ölige Produkt und fängt das, was über 190 °C übergeht, besonders auf; letzteres wird als rohes Kresol, das, was unter 190 °C übergeht, als rohe Karbolsäure verkauft. Beide Substanzen sind in diesem Zustande noch braune, sehr übel riechende, ölige Flüssigkeiten. Diese rohe Karbolsäure (acidum carbolicum crudum) wird teils weiter gereinigt, teils wird sie zur Konservierung von Holz und zum Desinfizieren von Abtrittgruben verwendet.“
Weblinks |
Einzelnachweise |
↑ August Laurent: Ueber das Phenol (Phenyloxydhydrat, phenylige Säure). In: Journal für Praktische Chemie. 52, 1851, S. 279–282. doi:10.1002/prac.18510520125.
↑ abcdefghijklm Eintrag zu Phenol in der GESTIS-Stoffdatenbank des IFA, abgerufen am 8. Januar 2018 (JavaScript erforderlich).
↑ abcd Eintrag zu Phenol. In: Römpp Online. Georg Thieme Verlag, abgerufen am 9. Juni 2013.
↑ CRC Handbook of Tables for Organic Compound Identification, Third Edition, 1984, ISBN 0-8493-0303-6.
↑ David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press/Taylor and Francis, Boca Raton, FL, Physical Constants of Organic Compounds, S. 3-422.
↑ Eintrag zu Phenol im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. Februar 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
↑ Schweizerische Unfallversicherungsanstalt (SUVA): Grenzwerte am Arbeitsplatz 2015 – MAK-Werte, BAT-Werte, Grenzwerte für physikalische Einwirkungen, abgerufen am 2. November 2015.
↑ Grenzwerte für Arbeitsstoffe, Verordnung des Bundesministers für Arbeit, Soziales und Konsumentenschutz (Grenzwerteverordnung GKV 2011), Österreich.
↑ abc W. B. Deichmann: Toxicology of Drugs and Chemicals. New York 1969, Academic Press, S. 463.
↑ ab R. Lefaux, O. H. Cleveland: Practical Toxicology of Plastics. Chemical Rubber Co., 1968, S. 329.
↑ Max Bloch, in Günther Bugge, Das Buch der großen Chemiker, Band 2, Verlag Chemie, Berlin 1930, S. 92–114.
↑ Heinz Lüllmann, Klaus Mohr, Lutz Hein, Pharmakologie und Toxikologie, Georg Thieme, Stuttgart, 2010, S. 541 (eingeschränkte Vorschau in der Google-Buchsuche).
↑ Die SS-Ärzte. Website der KZ Gedenkstätte Mauthausen. Abgerufen am 7. Oktober 2015.
↑ Hans Halter: Die Mörder sind noch unter uns. NS-Ärzte - Von der Euthanasie. Bericht im Spiegel 25/1988, 20. Juni 1988, S. 112–122.
↑ Karin Orth: Das System der nationalsozialistischen Konzentrationslager. Eine politische Organisationsgeschichte. Hamburg 1999.
↑ Karl-Heinz Lautenschläger, Werner Schröter, Joachim Teschner, Hildegard Bibrack, Taschenbuch der Chemie, 18. Auflage, Harri Deutsch, Frankfurt (Main), 2001.
↑ Hans-Dieter Jakubke, Ruth Karcher (Hrsg.): Lexikon der Chemie, Spektrum Akademischer Verlag, Heidelberg, 2001.
↑ Arnold Willmes, Taschenbuch Chemische Substanzen, Harri Deutsch, Frankfurt (M.), 2007, S. 583.
↑ S. A. Lawrence: Amines: synthesis, properties and applications, Cambridge University Press, 2004, ISBN 978-0-521-78284-5, S. 80.
↑ H.-J. Arpe, K. Weissermel: Industrielle Organische Chemie: Bedeutende Vor- und Zwischenprodukte. 6. Auflage, Wiley-VCH, 2007, ISBN 978-3-527-31540-6, S. 418.
↑ Community rolling action plan (CoRAP) der Europäischen Chemikalienagentur (ECHA): Phenol, abgerufen am 31. Oktober 2017.Vorlage:CoRAP-Status/2015
↑ Karbolsäure. In: Merck’s Warenlexikon. 3. Aufl. 1884 ff., S. 250 f.
| Dieser Artikel behandelt ein Gesundheitsthema. Er dient nicht der Selbstdiagnose und ersetzt keine Arztdiagnose. Bitte hierzu den Hinweis zu Gesundheitsthemen beachten! |




![{mathrm {C_{6}H_{5}OH + NH_{3} {xrightarrow[ {Kat.}]{250^{{circ }}C}} C_{6}H_{5}NH_{2} + H_{2}O}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/ee2fee96963f62879e3117c093e3eb5dca2a51fe)
