Cyclooctatetraen
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Cyclooctatetraen | |||||||||||||||
| Andere Namen |
| |||||||||||||||
Summenformel | C8H8 | |||||||||||||||
| Kurzbeschreibung | gelbe Flüssigkeit mit unangenehmem Geruch[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
Molare Masse | 104,15 g·mol−1 | |||||||||||||||
Aggregatzustand | flüssig | |||||||||||||||
Dichte | 0,93 g·cm−3[1] | |||||||||||||||
Schmelzpunkt | 0 °C[2] | |||||||||||||||
Siedepunkt | 142–143 °C [1] | |||||||||||||||
Dampfdruck | 10,5 hPa (20 °C)[2] | |||||||||||||||
Löslichkeit | nahezu unlöslich in Wasser[1] | |||||||||||||||
Brechungsindex | 1,5381 (20 °C)[3] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | ||||||||||||||||
Cyclooctatetraen (COT) ist eine organisch-chemische Verbindung aus der Gruppe der cyclischen Kohlenwasserstoffe. Die Verbindung mit der Summenformel C8H8 besitzt vier konjugierte C=C-Doppelbindungen.

dreidimensionale Gerüstformel in all-(Z)-Konfiguration mit sichtbarer Wannenkonformation
Im Gegensatz zu Benzol (C6H6) zählt COT nicht zu den aromatischen Kohlenwasserstoffen, da es aufgrund der Anzahl seiner π-Elektronen nicht der Hückel-Regel entspricht und auch nicht planar ist, sondern Wannenform besitzt. Somit ist Cyclooctatetraen weder ein Aromat, noch ein Antiaromat.[5] Durch die fehlende aromatische Stabilisierung ist es eher den gewöhnlichen Polyenen vergleichbar, allerdings aufgrund der durch die Ringspannung verursachten Bindungswinkeldeformation von erhöhter Reaktivität.
Das wannenförmige COT-Molekül kann als Chelatligand – ähnlich wie 1,5-Cyclooctadien (COD) – Metallkomplexe bilden. Durch die Aufnahme von zwei Elektronen, z. B. durch Übertragung von einem Metall, wird aus dem COT das planare, aromatische Cyclooctatetraenyl-Anion C8H82− mit zehn π-Elektronen und erfüllt damit die Hückel-Regel. Ein bekanntes Beispiel für einen Komplex mit planaren Cyclooctatetraenyl-Liganden ist das Uranocen.
Darstellung |
COT wurde erstmals 1905 von Richard Willstätter aus Pseudopelletierin synthetisiert.[6]
COT kann durch Cyclotetramerisierung nach Reppe aus Ethin hergestellt werden:[7]
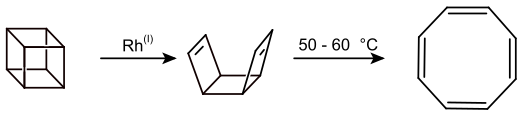
Eine andere Synthese geht vom Cuban aus. In Gegenwart von Rhodiumkatalysatoren wird zunächst das syn-Tricyclooctadien gebildet, welches anschließend thermisch bei 50–60 °C zum Cyclooctatetraen umgewandelt werden kann.[8]
Einzelnachweise |
↑ abcd Datenblatt Cyclooctatetraen bei AlfaAesar, abgerufen am 7. Januar 2008 (PDF) (JavaScript erforderlich).
↑ ab Datenblatt Cyclooctatetraen bei Acros, abgerufen am 19. Februar 2010.
↑ David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press/Taylor and Francis, Boca Raton, FL, Physical Constants of Organic Compounds, S. 3-130.
↑ ab Datenblatt Cyclooctatetraene bei Sigma-Aldrich, abgerufen am 7. November 2016 (PDF).
↑
Frank-Gerrit Klärner: Wie antiaromatisch ist planares Cyclooctatetraen? In: Angewandte Chemie. Band 113, Nr. 21, 2001, S. 4099–4103, doi:10.1002/1521-3757(20011105)113:21<4099::AID-ANGE4099>3.0.CO;2-1.
↑ Richard Willstätter, Ernst Waser: Über Cyclo-octatetraen. In: Berichte der deutschen chemischen Gesellschaft. Band 44, Nr. 3, 1911, S. 3423–3445, doi:10.1002/cber.191104403216.
↑
Walter Reppe, Otto Schlichting, Karl Klager, Tim Toepel: Cyclisierende Polymerisation von Acetylen I. Über Cyclooctatetraen. In: Justus Liebigs Annalen der Chemie. Band 560, Nr. 1, 1948, S. 1–92, doi:10.1002/jlac.19485600102.
↑ L. Cessar, P.E. Eaton, J. Halpern: Catalysis of symmetry-restricted reactions by transition metal compounds. Valence isomerization of cubane, In J. Am. Chem. Soc. 92, 1972, S. 3515-3518. doi:10.1021/ja00714a075.