Aluminium
| Eigenschaften | |||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
[Ne] 3s2 3p1 13Al Periodensystem | |||||||||||||||||||||||||||||||||||||
| Allgemein | |||||||||||||||||||||||||||||||||||||
Name, Symbol, Ordnungszahl | Aluminium, Al, 13 | ||||||||||||||||||||||||||||||||||||
Serie | Metalle | ||||||||||||||||||||||||||||||||||||
Gruppe, Periode, Block | 13, 3, p | ||||||||||||||||||||||||||||||||||||
Aussehen | silbrig | ||||||||||||||||||||||||||||||||||||
CAS-Nummer | 7429-90-5 | ||||||||||||||||||||||||||||||||||||
| Massenanteil an der Erdhülle | 7,57 %[1] | ||||||||||||||||||||||||||||||||||||
| Atomar [2] | |||||||||||||||||||||||||||||||||||||
Atommasse | 26,9815385(7)[3][4]u | ||||||||||||||||||||||||||||||||||||
Atomradius (berechnet) | 125 (118) pm | ||||||||||||||||||||||||||||||||||||
Kovalenter Radius | 121 pm | ||||||||||||||||||||||||||||||||||||
Van-der-Waals-Radius | 184[5] pm | ||||||||||||||||||||||||||||||||||||
Elektronenkonfiguration | [Ne] 3s2 3p1 | ||||||||||||||||||||||||||||||||||||
Austrittsarbeit | 4,06–4,26 eV[6] | ||||||||||||||||||||||||||||||||||||
| 1. Ionisierungsenergie | 577,5 kJ/mol | ||||||||||||||||||||||||||||||||||||
| 2. Ionisierungsenergie | 1816,7 kJ/mol | ||||||||||||||||||||||||||||||||||||
| 3. Ionisierungsenergie | 2744,8 kJ/mol | ||||||||||||||||||||||||||||||||||||
| Physikalisch [2] | |||||||||||||||||||||||||||||||||||||
Aggregatzustand | fest | ||||||||||||||||||||||||||||||||||||
Kristallstruktur | kubisch flächenzentriert | ||||||||||||||||||||||||||||||||||||
Dichte | 2,6989 g/cm3 (20 °C)[7] | ||||||||||||||||||||||||||||||||||||
Mohshärte | 2,75 | ||||||||||||||||||||||||||||||||||||
Magnetismus | paramagnetisch (Χm = 2,1 · 10−5)[8] | ||||||||||||||||||||||||||||||||||||
Schmelzpunkt | 933,35 K (660,2[9] °C) | ||||||||||||||||||||||||||||||||||||
Siedepunkt | 2743 K[10] (2470 °C) | ||||||||||||||||||||||||||||||||||||
Molares Volumen | 10,00 · 10−6 m3/mol | ||||||||||||||||||||||||||||||||||||
Verdampfungswärme | 284 kJ/mol[10] | ||||||||||||||||||||||||||||||||||||
Schmelzwärme | 10,7[11] kJ/mol | ||||||||||||||||||||||||||||||||||||
Schallgeschwindigkeit | 6250–6500 (Longitudinalwelle) m/s; 3100 (Scherwelle)[12][13] m/s bei 293,15 K | ||||||||||||||||||||||||||||||||||||
Spezifische Wärmekapazität | 897[1] J/(kg · K) | ||||||||||||||||||||||||||||||||||||
Elektrische Leitfähigkeit | 37,7 · 106 A/(V · m) | ||||||||||||||||||||||||||||||||||||
Wärmeleitfähigkeit | 235 W/(m · K) | ||||||||||||||||||||||||||||||||||||
| Mechanisch [2] | |||||||||||||||||||||||||||||||||||||
E-Modul | 60 bis 78 kN/mm²[14] | ||||||||||||||||||||||||||||||||||||
Poissonzahl | 0,34[15] | ||||||||||||||||||||||||||||||||||||
| Chemisch [2] | |||||||||||||||||||||||||||||||||||||
Oxidationszustände | 1, 2, 3 | ||||||||||||||||||||||||||||||||||||
Oxide (Basizität) | Al2O3 (amphoter) | ||||||||||||||||||||||||||||||||||||
Normalpotential | −1,676 V (Al3+ + 3 e− → Al) | ||||||||||||||||||||||||||||||||||||
Elektronegativität | 1,61 (Pauling-Skala) | ||||||||||||||||||||||||||||||||||||
| Isotope | |||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||
| Weitere Isotope siehe Liste der Isotope | |||||||||||||||||||||||||||||||||||||
NMR-Eigenschaften | |||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||
Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||||||||||||||||||||
Aluminium ist ein chemisches Element mit dem Elementsymbol Al und der Ordnungszahl 13. Im Periodensystem gehört Aluminium zur dritten Hauptgruppe und zur 13. IUPAC-Gruppe, der Borgruppe, die früher auch als Gruppe der Erdmetalle bezeichnet wurde. Es gibt zahlreiche Aluminiumverbindungen.
Aluminium ist ein silbrig-weißes Leichtmetall. In der Erdhülle ist es, nach Sauerstoff und Silicium, das dritthäufigste Element und in der Erdkruste das häufigste Metall.
In der Werkstofftechnik werden mit „Aluminium“ alle Werkstoffe auf Basis des Elementes Aluminium verstanden. Dazu zählt Reinaluminium (mindestens 99,0 % Al), Reinstaluminium (min 99,7 % Al) und insbesondere die Aluminiumlegierungen, die Festigkeiten besitzen, die mit Stahl vergleichbar sind, bei nur einem Drittel seiner Dichte.
Entdeckt wurde Aluminium, das in der Natur nur in Form von chemischen Verbindungen, aber nicht als Metall vorkommt, im frühen 19. Jahrhundert. Im frühen 20. Jahrhundert setzte die industrielle Massenproduktion ein.
Die Gewinnung erfolgt in Aluminiumhütten ausgehend von dem Mineral Bauxit zunächst im Bayer-Verfahren, mit dem Aluminiumoxid gewonnen wird, und anschließend im Hall-Héroult-Prozess einer Schmelzflusselektrolyse, bei der Aluminium gewonnen wird. Weltweit wurden 2016 115 Mio. Tonnen Aluminiumoxid (Al2O3) produziert[20]. Daraus hat man 54,6 Mio. Tonnen Primäraluminium gewonnen[21].
Das Metall ist sehr unedel und reagiert an frisch angeschnittenen Stellen bei Raumtemperatur mit Luft und Wasser zu Aluminiumoxid. Dies bildet aber sofort eine dünne, für Luft und Wasser undurchlässige Schicht (Passivierung) und schützt so das Aluminium vor Korrosion. Reines Aluminium weist eine geringe Festigkeit auf; bei Legierungen ist sie deutlich höher. Die elektrische und thermische Leitfähigkeit ist hoch, weshalb Aluminium für leichte Kabel und Wärmetauscher verwendet wird.
Eines der bekanntesten Produkte ist Alufolie. Weitere sind Bauteile in Fahrzeugen und Maschinen, elektrische Leitungen, Rohre, Dosen und Haushaltsgegenstände. Das Aluminiumrecycling erreicht weltweit Raten von etwa 40 %.
Inhaltsverzeichnis
1 Geschichte
2 Vorkommen
3 Aluminium als Mineral
4 Gewinnung
4.1 Primäraluminium (Herstellung aus Mineralien)
4.2 Sekundäraluminium (Herstellung durch Aluminium-Recycling)
5 Eigenschaften
5.1 Physikalische Eigenschaften
5.1.1 Mikrostruktur
5.1.2 Dichte
5.1.3 Mechanische Eigenschaften
5.1.4 Thermische Eigenschaften
5.1.5 Elektrische Eigenschaften
5.1.6 Magnetische Eigenschaften
5.2 Chemische Eigenschaften
6 Isotope
7 Aluminiumlegierungen
8 Wirtschaftliche Bedeutung
9 Verwendung
9.1 Konstruktionswerkstoff allgemein
9.2 Fahrzeugbau
9.3 Elektrotechnik
9.3.1 Elektrische Leitungen
9.3.2 Elektronik
9.4 Verpackung und Behälter
9.5 Optik und Lichttechnik
9.6 Architektur und Bauwesen
9.6.1 Betonherstellung
9.6.2 Konstruktions- und Funktionswerkstoffe
9.7 Weitere Anwendungen
10 Verarbeitung
10.1 Gießen
10.2 Umformende Verfahren
10.3 Spanende Verfahren
10.4 Schweißen und Löten
11 Aluminium in Natur und Organismen
11.1 Aluminium im menschlichen Körper
11.2 Pflanzen
11.3 In Lebensmitteln
12 Toxizität
13 Aspekte der Ökobilanz
14 Nachweis
14.1 Nachweis mittels Kryolithprobe
14.2 Nachweis als fluoreszierender Morinfarblack
15 Verbindungen
16 Siehe auch
17 Literatur
18 Weblinks
19 Einzelnachweise
Geschichte


1782 vermutete Lavoisier als erster, dass es sich bei der 1754 von Marggraf aus einer Alaunlösung gewonnenen Alaunerde (alumina, abgeleitet von lateinisch alumen ‚Alaun‘) um das Oxid eines bislang unbekannten Elements handle. Dessen Darstellung glückte schließlich 1825 dem Dänen Hans Christian Ørsted durch Reaktion von Aluminiumchlorid (AlCl3) mit Kaliumamalgam, wobei Kalium als Reduktionsmittel diente:[22]
- 4 AlCl3+3 K→Al+3 KAlCl4{displaystyle mathrm {4 AlCl_{3}+3 Krightarrow Al+3 KAlCl_{4}} }
Davy, der sich lange Zeit ebenfalls an der Darstellung des neuen Elements versucht hatte, führte ab 1807 die Namensvarianten alumium, aluminum und aluminium ein, von welchen die letzten beiden im Englischen bis heute nebeneinander fortbestehen.[23][24]
1827 gelang es Friedrich Wöhler mit der gleichen Methode wie Ørsted, jedoch unter Verwendung metallischen Kaliums als Reduktionsmittel, reineres Aluminium zu gewinnen. Henri Étienne Sainte-Claire Deville verfeinerte den Wöhler-Prozess im Jahr 1846 und publizierte ihn 1859 in einem Buch. Durch diesen verbesserten Prozess stieg die Ausbeute bei der Aluminiumgewinnung, und in der Folge fiel der Preis des Aluminiums, der zuvor höher als jener von Gold gewesen war, innerhalb von zehn Jahren auf ein Zehntel.
1886 wurde unabhängig voneinander durch Charles Martin Hall und Paul Héroult das nach ihnen benannte Elektrolyseverfahren zur Herstellung von Aluminium entwickelt: der Hall-Héroult-Prozess. 1889 entwickelte Carl Josef Bayer das nach ihm benannte Bayer-Verfahren zur Isolierung von reinem Aluminiumoxid aus Bauxiten. Aluminium wird noch heute nach diesem Prinzip großtechnisch hergestellt.
Am Ende des 19. Jahrhunderts stand das Metall in solchem Ansehen, dass man daraus gefertigte Metallschiffe auf den Namen Aluminia taufte.
Vorkommen
Aluminium ist mit einem Anteil von 7,57 Gewichtsprozent nach Sauerstoff und Silicium das dritthäufigste Element der Erdkruste und damit das häufigste Metall. Allerdings kommt es aufgrund seines unedlen Charakters praktisch ausschließlich in gebundener Form vor. Die größte Menge befindet sich chemisch gebunden in Form von Alumosilicaten, in denen es in der Kristallstruktur die Position von Silicium in Sauerstoff-Tetraedern einnimmt. Diese Silicate sind zum Beispiel Bestandteil von Ton, Gneis und Granit.
Seltener wird Aluminiumoxid in Form des Minerals Korund und seiner Varietäten Rubin (rot) und Saphir (farblos, verschiedenfarbig) gefunden. Die Farben dieser Kristalle beruhen auf Beimengungen anderer Metalloxide. Korund hat mit fast 53 Prozent den höchsten Aluminiumanteil einer Verbindung. Einen ähnlich hohen Aluminiumanteil haben die noch selteneren Minerale Akdalait (etwa 51 Prozent) und Diaoyudaoit (etwa 50 Prozent). Insgesamt sind bisher (Stand: 2017) 1156 aluminiumhaltige Minerale bekannt.[25]
Das einzige wirtschaftlich wichtige Ausgangsmaterial für die Aluminiumproduktion ist Bauxit. Vorkommen befinden sich in Südfrankreich (Les Baux), Guinea, Bosnien und Herzegowina, Ungarn, Russland, Indien, Jamaika, Australien, Brasilien und den Vereinigten Staaten. Bauxit enthält ungefähr 60 Prozent Aluminiumhydroxid (Al(OH)3 und AlO(OH)), etwa 30 Prozent Eisenoxid (Fe2O3) und Siliciumdioxid (SiO2).
Bei der Herstellung unterscheidet man Primäraluminium, auch Hüttenaluminium genannt, das aus Bauxit gewonnen wird, und Sekundäraluminium aus Aluminiumschrott. Die Wiederverwertung benötigt nur etwa 5 Prozent der Energie der Primärgewinnung.
Aluminium als Mineral
Infolge der Passivierung kommt Aluminium in der Natur sehr selten auch elementar (gediegen) vor. Aluminium ist daher von der International Mineralogical Association (IMA) als eigenständiges Mineral anerkannt (Interne Eingangs-Nr. der IMA: 1980-085 und 1980-085a).[26] Gemäß der Systematik der Minerale nach Strunz (9. Auflage) wird Aluminium unter der System-Nummer 1.AA.05 (Elemente – Metalle und intermetallische Verbindungen – Kupfer-Cupalit-Familie – Kupfergruppe)[27] beziehungsweise in der veralteten 8. Auflage unter I/A.03 eingeordnet. Die vorwiegend im englischsprachigen Raum verwendete Systematik der Minerale nach Dana führt das Element-Mineral unter der System-Nr. 01.01.01.05.[28]
Erstmals entdeckt wurde Aluminium 1978 durch B. V. Oleinikov, A. V. Okrugin, N. V. Leskova in Mineralproben aus der Billeekh Intrusion und dem Dyke OB-255 in der Republik Sacha (Jakutien) im russischen Föderationskreis Ferner Osten.[29][30] Insgesamt sind weltweit bisher rund 20 Fundorte (Stand 2017) für gediegen Aluminium bekannt, so unter anderem in Aserbaidschan, Bulgarien, der Volksrepublik China (Guangdong, Guizhou, Jiangsu und Tibet) und in Venezuela. Zudem konnte gediegen Aluminium in Gesteinsproben vom Mond, das die Sonde der Luna-20-Mission vom Krater Apollonius mitbrachte, nachgewiesen werden.[31] Aufgrund der extremen Seltenheit hat gediegenes Aluminium keine Bedeutung als Rohstoffquelle.
In der Natur kommt gediegenes Aluminium meist in Form körniger Mineral-Aggregate und Mikronuggets vor, kann in seltenen Fällen aber auch tafelige Kristalle bis etwa einen Millimeter Größe entwickeln. Frische Mineralproben sind von metallisch glänzender, silberweißer Farbe. An der Luft dunkeln die Oberflächen durch Oxidierung nach und wirken grau. Auf der Strichtafel hinterlässt Aluminium einen dunkelgrauen Strich.[32]
Je nach Fundort enthält Aluminium oft Fremdbeimengungen von anderen Metallen (Cu, Zn, Sn, Pb, Cd, Fe, Sb) oder tritt eingewachsen in bzw. mikrokristallin verwachsen mit Hämatit, Ilmenit, Magnetit, Moissanit und Pyrit bzw. Jarosit auf.[33]
Typmaterial, das heißt Mineralproben aus der Typlokalität des Minerals, wird im Geologischen Museum der Akademie der Wissenschaften in Jakutsk in der russischen Teilrepublik Sacha (Jakutien) aufbewahrt.[33]
Gewinnung
Primäraluminium (Herstellung aus Mineralien)

Zeitliche Entwicklung der weltweiten Primäraluminiumproduktion
Aluminiummetall wird elektrolytisch aus einer Aluminiumoxidschmelze hergestellt. Da diese aus den auf der Erde allgegenwärtigen Alumosilicaten nur schwer isoliert werden kann, erfolgt die großtechnische Gewinnung aus dem relativ seltenen, silikatärmeren Bauxit. Zur Gewinnung von reinem Aluminiumoxid aus Silikaten gibt es seit langem[34] Vorschläge, deren Umsetzung allerdings bis heute nicht wirtschaftlich möglich ist.
Das im Erz enthaltene Aluminiumoxid/-hydroxid-Gemisch wird zunächst mit Natronlauge aufgeschlossen (Bayer-Verfahren, Rohrreaktor- oder Autoklaven-Aufschluss), um es von Fremdbestandteilen wie Eisen- und Siliciumoxid zu befreien, und wird dann überwiegend in Wirbelschichtanlagen (aber auch in Drehrohröfen) zu Aluminiumoxid (Al2O3) gebrannt.
Der trockene Aufschluss (Deville-Verfahren) hat dagegen keine Bedeutung mehr. Dabei wurde feinstgemahlenes, ungereinigtes Bauxit zusammen mit Soda und Koks in Drehrohröfen bei rund 1200 °C kalziniert und das entstehende Natriumaluminat anschließend mit Natronlauge gelöst.

Schema der Schmelzelektrolyse
Die Herstellung des Metalls erfolgt in Aluminiumhütten durch Schmelzflusselektrolyse von Aluminiumoxid nach dem Kryolith-Tonerde-Verfahren (Hall-Héroult-Prozess). Zur Herabsetzung des Schmelzpunktes wird das Aluminiumoxid zusammen mit Kryolith geschmolzen (Eutektikum bei 963 °C).[35] Bei der Elektrolyse entsteht an der den Boden des Gefäßes bildenden Kathode Aluminium und an der Anode Sauerstoff, der mit dem Graphit (Kohlenstoff) der Anode zu Kohlenstoffdioxid und Kohlenstoffmonoxid reagiert. Die Graphitblöcke, welche die Anode bilden, brennen so langsam ab und werden von Zeit zu Zeit ersetzt. Die Graphitkathode (Gefäßboden) ist gegenüber Aluminium inert. Das sich am Boden sammelnde flüssige Aluminium wird mit einem Saugrohr abgesaugt.

Alubarren aus dem Werk in Gampel im Kanton Wallis

Stranggegossene Rundbarren aus Aluminium
Aufgrund der hohen Bindungsenergie durch die Dreiwertigkeit des Aluminiums ist der Prozess recht energieaufwändig. Pro produziertem Kilogramm Rohaluminium müssen 12,9 bis 17,7 Kilowattstunden an elektrischer Energie eingesetzt werden.[36][37] Eine Reduzierung des Strombedarfs ist nur noch in geringem Ausmaß möglich, weil die Potentiale für energetische Optimierungen weitgehend erschlossen sind.[38] Aluminiumherstellung ist daher nur in der Nähe preiswert zur Verfügung stehender Elektroenergie wirtschaftlich, beispielsweise neben Wasserkraftwerken, wie in Rheinfelden oder (ehemals) in Ranshofen unweit des Inns.
| Land | Förderung | Reserven | Vorratsbasis (2009)[40] |
|---|---|---|---|
Australien | 77.000 | 6.000.000 | 7.900.000 |
China Volksrepublik | 47.000 | 830.000 | 2.300.000 |
Brasilien | 34.200 | 2.600.000 | 2.500.000 |
Indonesien | 30.000 | 1.000.000 | |
Indien | 19.000 | 540.000 | 1.400.000 |
Guinea | 17.000 | 7.400.000 | 8.600.000 |
Jamaika | 9.500 | 2.000.000 | 2.500.000 |
Die nachfolgende Tabelle zeigt die Aluminiumproduktion und die maximal mögliche Produktionsleistung der Hüttenwerke nach Ländern.
| Rang | Land | Produktion | Kapazität |
|---|---|---|---|
| 1. | China | 13.000 | 19.000 |
| 2. | Russland | 3.300 | 5.150 |
| 3. | Kanada | 3.000 | 3.090 |
| 4. | Australien | 1.970 | 1.970 |
| 5. | USA | 1.710 | 3.500 |
| 6. | Indien | 1.600 | 2.000 |
| 7. | Brasilien | 1.550 | 1.700 |
| 8. | Norwegen | 1.200 | 1.230 |
| 9. | VAE | 950 | 950 |
| 10. | Bahrain | 870 | 880 |
| 11. | Südafrika | 800 | 900 |
| 12. | Island | 790 | 790 |
| 13. | Venezuela | 550 | 625 |
| 14. | Deutschland | 520 | 620 |
| 15. | Mosambik | 500 | 570 |
| 16. | Andere Länder | 4.600 | 6.920 |
| Welt | 36.900 | 49.900 |
Sekundäraluminium (Herstellung durch Aluminium-Recycling)
Um Aluminium zu recyceln, werden Aluminiumschrotte und „Krätzen“ in Trommelöfen eingeschmolzen. „Krätze“ ist ein Abfallprodukt bei der Verarbeitung von Aluminium und bei der Herstellung von Sekundäraluminium. Krätze ist ein Gemisch aus Aluminiummetall und feinkörnigen Oxidpartikeln und wird beim Schmelzen von Aluminium bei 800 °C aus dem Aluminiumoxid der normalen Aluminiumkorrosion und als Oxidationsprodukt (Oxidhaut) beim Kontakt von flüssigem Aluminium mit Luftsauerstoff gebildet. Damit beim Aluminiumgießen keine Aluminiumoxidpartikel in das Gussteil gelangen, wird die Krätze durch Kratzvorrichtungen von der Oberfläche des Metallbads abgeschöpft.
Um die Bildung von Krätze zu verhindern, wird die Oberfläche der Schmelze mit Halogenidsalzen (rund zwei Drittel NaCl, ein Drittel KCl und geringe Mengen Calciumfluorid CaF2) abgedeckt (siehe dazu Aluminiumrecycling). Dabei entsteht als Nebenprodukt Salzschlacke, die noch ca. 10 Prozent Aluminium enthält, die, entsprechend aufbereitet, als Rohstoff für mineralische Glasfasern dient.[42]
Allerdings steht das Sekundäraluminium im Ruf, dass beim Recycling pro Tonne jeweils 300 bis 500 Kilogramm Salzschlacke, verunreinigt mit Dioxinen und Metallen, entsteht, deren mögliche Wiederverwertung aber Stand der Technik ist.[43][44]
Eigenschaften
Physikalische Eigenschaften
Spektrallinien des Aluminium

Geätzte Oberfläche eines hochreinen (99,9998 %) Aluminium-Barrens, Größe 55 mm × 37 mm

Hochreines Aluminium (99,99 %), makrogeätzt
Mikrostruktur
Aluminium erstarrt ausschließlich in einem kubisch flächenzentrierten Raumgitter in der Raumgruppe Fm3m (Raumgruppen-Nr. 225)Vorlage:Raumgruppe/225. Der Gitterparameter beträgt bei Reinaluminium 0,4049 nm[45] (entspricht 4,05 Å) bei 4 Formeleinheiten pro Elementarzelle.[46]
Leerstellen kommen mit einer Dichte von 1,3 × 10−4 bei 500 °C vor, bei Raumtemperatur sind es nur noch 10−12. Durch Abschrecken können auch größere Leerstellendichten bei Raumtemperatur vorkommen, was für einige Eigenschaften von Aluminiumwerkstoffen von Bedeutung ist, da die Leerstellen die Diffusion begünstigen. Durch Umformen bei Raumtemperatur kann die Leerstellendichte auf 10−4 erhöht werden. Die Versetzungsdichte liegt bei 10−7, einem für Metalle typischen Bereich, und führt zur guten Umformbarkeit von Aluminium. Stapelfehler konnten bei Aluminium nicht nachgewiesen werden, was mit der hohen Stapelfehlerenergie von 103 bis 200 (10−7 J/cm²) erklärt wird. Dies führt dazu, dass die Festigkeitsteigerung beim Kaltwalzen und -schmieden nur gering ausfällt und manche Aluminiumwerkstoffe sogar anschließend zur Entfestigung neigen.[47]
Dichte
Mit einer Dichte von 2,6989 g/cm³[48] (etwa ein Drittel von Stahl) ist Aluminium ein typisches Leichtmetall, was es als Werkstoff für den Leichtbau interessant macht. Die Dichte der Legierungen weicht meist nur um etwa +3 % bis −2 % ab. Spezielle Legierungen mit Lithium haben eine 15 % geringere Dichte. Aluminium zählt somit zu den leichtesten Werkstoffen, übertroffen nur noch von Magnesium.[49]
Mechanische Eigenschaften
Aluminium ist ein relativ weiches und zähes Metall. Die Zugfestigkeit von absolut reinem Aluminium liegt bei 45 N/mm², die Streckgrenze bei 17 N/mm² und die Bruchdehnung bei 60 %, während bei handelsüblich reinem Aluminium die Zugfestigkeit bei 90 N/mm² liegt, die Streckgrenze bei 34 N/mm² und die Bruchdehnung bei 45 %.[50] Die Zugfestigkeit seiner Legierungen liegt dagegen bei bis zu 710 N/mm² (Legierung 7068). Sein Elastizitätsmodul liegt bei etwa 70 GPa,[50] einem häufig angegebenen Wert. Für Reinaluminium wird ein Wert von 66,6 GPa angegeben,[48][51] die Werte schwanken jedoch von 60 bis 78 GPa[52]. Der G-Modul liegt bei 25,0 kN/mm²[53], die Querkontraktionszahl (Poissonzahl) bei 0,35.[48]
Thermische Eigenschaften
Die Schmelztemperatur liegt bei 660,2 °C und die Siedetemperatur bei 2470 °C. Die Schmelztemperatur ist deutlich niedriger als die von Kupfer (1084,6 °C), Gusseisen (1147 °C) und Eisen (1538 °C), was Aluminium zu einem guten Gusswerkstoff macht.
Bei einer Sprungtemperatur von 1,2 K wird reines Aluminium supraleitend.[54]
Die Wärmeleitfähigkeit liegt mit 235 W/(K m) relativ hoch. Die Wärmeleitfähigkeit von Kupfer liegt zwar etwa doppelt so hoch, dafür ist die Dichte etwa viermal größer, weshalb Aluminium für Wärmetauscher in Fahrzeugen genutzt wird.[55] Der Wärmeausdehnungskoeffizient ist durch den recht niedrigen Schmelzpunkt mit 23,1 µm·m−1·K−1 recht hoch.
Die Schwindung, also die Volumenabnahme beim Erstarren liegt bei 7,1 %.[48]
Elektrische Eigenschaften
Da thermische und elektrische Leitfähigkeit bei Metallen von denselben Mechanismen dominiert werden, ist Aluminium mit 37,67m/Ωmm2{displaystyle 37{,}67,mathrm {m/Omega mm^{2}} }
Magnetische Eigenschaften
Aluminium ist paramagnetisch, wird also von Magneten angezogen, der Effekt ist jedoch sehr schwach ausgeprägt. Die Magnetische Suszeptibilität liegt bei Raumtemperatur bei 0,62 × 10−9 m³/kg, womit Aluminium praktisch gesehen unmagnetisch ist.[57]
Chemische Eigenschaften
 Mediendatei abspielen
Mediendatei abspielenAufhebung der Passivierung von Aluminium durch ca. 1 mg Quecksilber (Aufnahme im Zeitraffer)
Das reine Leichtmetall Aluminium hat aufgrund einer sich sehr schnell an der Luft bildenden dünnen Oxidschicht ein stumpfes, silbergraues Aussehen. Diese passivierende Oxidschicht macht reines Aluminium bei pH-Werten von 4 bis 9 sehr korrosionsbeständig, sie erreicht eine Dicke von etwa 0,05 µm.[58]
Diese Oxidschicht schützt auch vor weiterer Oxidation, ist aber bei der elektrischen Kontaktierung und beim Löten hinderlich. Sie kann durch elektrische Oxidation (Eloxieren) oder auf chemischem Weg verstärkt werden.
Die Oxidschicht kann mittels Komplexbildungsreaktionen aufgelöst werden. Einen außerordentlich stabilen und wasserlöslichen Neutralkomplex geht Aluminium in neutraler chloridischer Lösung ein. Folgende Reaktionsgleichung veranschaulicht den Vorgang:
- Al2O3(s)+2 Cl−(aq)+3 H2O(l)⟶2 [Al(OH)2Cl](aq)+2 OH−(aq){displaystyle mathrm {Al_{2}O_{3}(s)+2 Cl^{-}(aq)+3 H_{2}O(l)longrightarrow 2 [Al(OH)_{2}Cl](aq)+2 OH^{-}(aq)} }
Dies geschieht vorzugsweise an Stellen, wo die Oxidschicht des Aluminiums bereits geschädigt ist. Es kommt dort durch Bildung von Löchern zur Lochfraßkorrosion. Kann die chloridische Lösung dann an die freie Metalloberfläche treten, so laufen andere Reaktionen ab. Aluminium-Atome können unter Komplexierung oxidiert werden:
- Al(s)+4 H2O(l)+Cl−(aq)⟶[Al(OH)2Cl](aq)+3 e−+2 H3O+(aq){displaystyle mathrm {Al(s)+4 H_{2}O(l)+Cl^{-}(aq)longrightarrow [Al(OH)_{2}Cl](aq)+3 e^{-}+2 H_{3}O^{+}(aq)} }
Liegen in der Lösung Ionen edlerer Metalle vor, so werden sie reduziert und am Aluminium abgeschieden. Auf diesem Prinzip beruht die Reduktion von Silberionen, die auf der Oberfläche von angelaufenem Silber als Silbersulfid vorliegen, hin zu Silber.
Aluminium reagiert heftig mit wässriger von Natriumhydroxidlösung (NaOH) (und etwas weniger heftig mit wässriger Natriumcarbonatlösung) unter Bildung von Wasserstoff. Diese Reaktion wird in chemischen Rohrreinigungsmitteln ausgenutzt.
Die Reaktion von Aluminium mit NaOH läuft in zwei Schritten ab: der Reaktion mit Wasser und die Komplexierung des Hydroxids zu Natriumaluminat.
Bei der Reaktion mit Wasser
- 2 Al+6 H2O ⟶ 2 Al(OH)3+3 H2{displaystyle mathrm {2 Al+6 H_{2}O longrightarrow 2 Al(OH)_{3}+3 H_{2}} }
entsteht zunächst Aluminiumhydroxid.
In der Regel wird anschließend die Oberfläche getrocknet, dabei wird das Hydroxid in das Oxid umgewandelt:
- 2 Al(OH)3 ⟶ Al2O3+3 H2O{displaystyle mathrm {2 Al(OH)_{3} longrightarrow Al_{2}O_{3}+3 H_{2}O} }
Dies passiert jedoch nicht bei der Reaktion von Aluminium in wässriger Natronlauge.
Nun folgt der 2. Schritt, die Komplexierung des Hydroxids zu Natriumaluminat:
- Al(OH)3+Na++OH− ⟶ Na++Al(OH)4−{displaystyle mathrm {Al(OH)_{3}+Na^{+}+OH^{-} longrightarrow Na^{+}+Al(OH)_{4}^{-}} }
Durch die Komplexierung wird das gallertartige Hydroxid wasserlöslich und kann von der Metalloberfläche abtransportiert werden. Dadurch ist die Aluminiumoberfläche nicht mehr vor dem weiteren Angriff des Wassers geschützt und Schritt 1 läuft wieder ab.
Mit dieser Methode lassen sich – ebenso wie bei der Reaktion von Aluminium mit Säuren – pro zwei Mol Aluminium drei Mol Wasserstoffgas herstellen.
- 2 Al+6 HCl ⟶ 2 AlCl3+3 H2{displaystyle mathrm {2 Al+6 HCl longrightarrow 2 AlCl_{3}+3 H_{2}} }
Mit Brom reagiert Aluminium bei Zimmertemperatur unter Flammenerscheinung. Hierbei ist zu beachten, dass das entstehende Aluminiumbromid mit Wasser unter Bildung von Aluminiumhydroxid und Bromwasserstoffsäure reagiert.
- AlBr3+3 H2O⟶Al(OH)3+3 HBr{displaystyle mathrm {AlBr_{3}+3 H_{2}Olongrightarrow Al(OH)_{3}+3 HBr} }
Mit Quecksilber bildet Aluminium ein Amalgam. Wenn Quecksilber direkt mit Aluminium zusammenkommt, d. h., wenn die Aluminiumoxidschicht an dieser Stelle mechanisch zerstört wird, frisst Quecksilber Löcher in das Aluminium; unter Wasser wächst dann darüber Aluminiumoxid in Gestalt eines kleinen Blumenkohls. Daher wird Quecksilber in der Luftfahrt als Gefahrgut und „ätzende Flüssigkeit“ gegenüber Aluminiumwerkstoffen eingestuft.[59]
Auch mit Salzsäure reagiert Aluminium sehr heftig unter Wasserstoffentwicklung, von Schwefelsäure wird es langsam aufgelöst. In Salpetersäure wird es passiviert.
In Pulverform (Partikelgröße kleiner 500 µm) ist Aluminium vor allem dann, wenn es nicht phlegmatisiert ist, aufgrund seiner großen Oberfläche sehr reaktiv. Aluminium reagiert dann mit Wasser unter Abgabe von Wasserstoff zu Aluminiumhydroxid. Feinstes, nicht phlegmatisiertes Aluminiumpulver wird auch als Pyroschliff bezeichnet. Nicht phlegmatisierter Aluminiumstaub ist sehr gefährlich und entzündet sich bei Luftkontakt explosionsartig von selbst.
Isotope
In der Natur kommt ausschließlich das Isotop 27Al vor, das stabil ist und im Kern 14 Neutronen und 13 Protonen enthält. Es absorbiert keine Neutronen, weshalb Aluminium auch in Kernreaktoren genutzt wird. Alle anderen Isotope werden künstlich erzeugt und sind radioaktiv. Das stabilste dieser Isotope ist 26Al mit einer Halbwertszeit von einer Million Jahren. Durch Elektroneneinfang oder Beta-Zerfall entsteht daraus 26Mg, durch Einfangen eines Neutrons und anschließenden Gamma-Zerfall 27Al. Die Isotope 24Al bis 29Al (Außer 26Al und 27Al) haben Halbwertszeiten zwischen wenigen Sekunden und einigen hundert Sekunden. 23Al zerfällt mit einer Halbwertszeit von nur 0,13 Sekunden.[60]
Aluminiumlegierungen
Aluminiumlegierungen sind Legierungen, die überwiegend aus Aluminium bestehen. Für andere Legierungen, die Aluminium enthalten, siehe Abschnitt #Weitere Anwendungen.
Aluminium kann mit zahlreichen Metallen legiert werden, um bestimmte Eigenschaften zu fördern oder andere, ungewünschte Eigenschaften zu unterdrücken. Bei einigen Legierungen ist die Bildung der schützenden Oxidschicht (Passivierung) stark gestört, wodurch die daraus gefertigten Bauteile teils korrosionsgefährdet sind. Nahezu alle hochfesten Aluminiumlegierungen sind von dem Problem betroffen.
Es gibt Aluminiumknetlegierungen, die zur Weiterverarbeitung durch Walzen, Schmieden und Strangpressen gedacht sind und Gusswerkstoffe. Diese werden in Gießereien verwendet.[48][61]
Im Allgemeinen werden Aluminiumlegierungen in die zwei große Gruppen der Knet- und Gusslegierungen eingeteilt:[48][62]
- Aluminiumgusslegierungen. Typische Aluminiumgusslegierungen enthalten Silicium als Hauptlegierungselement (AlSi), es gibt aber auch Sorten mit Kupfer oder Magnesium als Gusslegierungen.[48][63]
- Aluminiumknetlegierungen, sie haben einen Anteil von etwa 75 % und werden weiter unterteilt nach dem Hauptlegierungselement(en) in
Reinaluminium mit Aluminiumgehalten von 99,0 % bis 99,9 %. Sie sind sehr leicht zu bearbeiten, haben geringe Festigkeit und gute Korrosionsbeständigkeit.[48][64]
Aluminium-Kupfer-Legierungen (AlCu): Sie haben mittlere bis hohe Festigkeit, sind aushärtbar, aber korrosionsanfällig und schlecht schweißbar. Sie können Zusätze von Magnesium oder Mangan enthalten.[48][65]
Aluminium-Mangan-Legierungen (AlMn): Sie haben geringe bis mittlere Festigkeit, sind korrosionsbeständig und gut zu verarbeiten.[48][66]
Aluminium-Magnesium-Legierungen (AlMg, ohne AlMgSi): Sie haben mittlere Festigkeiten, sind nicht aushärtbar, korrosionsbeständig, gut umformbar und schweißbar. Die meisten Sorten enthalten zusätzlich noch Mangan (AlMg(Mn)).[48][67]
Aluminium-Magnesium-Silicium-Legierungen (AlMgSi): Sie haben mittlere bis hohe Festigkeiten, sind gut zu bearbeiten durch Schweißen und Strangpressen, aushärtbar und korrosionsbeständig.[48][68]
Aluminium-Zink-Magnesium-Legierungen (AlZnMg): Kupferfreie Sorten haben mittlere bis hohe Festigkeiten und sind gut schweißbar. Kupferhaltige Sorten (AlZnMg(Cu)) haben hohe bis sehr hohe Festigkeiten, sind nicht durch Schmelzschweißen bearbeitbar, aber sehr gut durch Zerspanen (Fräsen, Bohren) zu bearbeiten.[48][69]
- Sonderlegierungen, beispielsweise Aluminium-Lithium-Legierungen mit besonders geringer Dichte, oder Automatenlegierungen die besonders gut zerspanbar sind.[70]
Außerdem wird unterschieden zwischen naturharten Legierungen – welche sich durch eine Wärmebehandlung nicht härten lassen – und aushärtbaren:
- Typische naturharte Aluminiumknetlegierungen sind: AlMg, AlMn, AlMgMn, AlSi
- Aushärtbare Knetlegierungen – Festigkeitssteigerung durch Ausscheidungshärtung von Legierungselementen bei einer zusätzlichen Alterungsglühung bei 150 bis 190 °C. Typische aushärtbare Aluminiumknetlegierungen sind: AlMgSi, AlCuMg, AlZnMg. Die erste hochfeste, aushärtbare Aluminiumlegierung AlCuMg bekam 1907 die Handelsbezeichnung Duraluminium, kurz „Dural“ genannt.
Wirtschaftliche Bedeutung
Aluminium ist nach Stahl der zweitwichtigste metallische Werkstoff. 2016 wurden weltweit 115 Mio. Tonnen produziert.[71]
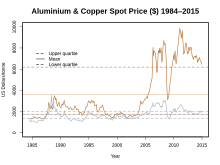
Der Aluminiumpreis im Vergleich zum Kupferpreis
Aluminium
Kupfer
Der Aluminiumpreis bewegte sich am Weltmarkt seit 1980 um den Wert von 2000 Dollar pro Tonne (Reinheit von 99,7 %). Er ist jedoch relativ volatil, 2016 fiel er auf um die 1500 Dollar pro Tonne, während er 2017 wieder bei annähernd 2000 Dollar lag.[72]
Verwendung
Konstruktionswerkstoff allgemein

Typisches Druckguss-Teil aus einer Aluminiumlegierung (Teil eines Staubsaugergebläses)
Aluminium weist eine hohe spezifische Festigkeit auf. Verglichen mit Stahl sind Bauteile aus Aluminium bei gleicher Festigkeit etwa halb so schwer, weisen jedoch ein größeres Volumen auf.[73] Deshalb wird es gern im Leichtbau verwendet, also dort, wo es auf geringe Masse ankommt, die zum Beispiel bei Transportmitteln zum geringeren Treibstoffverbrauch beiträgt, vor allem in der Luft- und Raumfahrt. Auch im Kraftfahrzeugbau gewann es aus diesem Grund an Bedeutung; hier standen früher der hohe Materialpreis, die schlechtere Schweißbarkeit sowie die problematische Dauerbruchfestigkeit und die Verformungseigenschaften bei Unfällen (geringes Energieaufnahmevermögen in der sogenannten Knautschzone) im Wege. Die Haube des Washington-Denkmals, ein 3 kg schweres Gussstück, galt bis 1884 als eines der größten Aluminiumwerkstücke.[74] Beim Bau von kleinen und mittleren Schiffen und Booten wird die Korrosionsbeständigkeit von Aluminium gegenüber Salzwasser geschätzt.[75] Der Fahrzeugbau (inklusive Schiffen, Flugzeugen und Schienenfahrzeugen) machte 2010 mit ca. 35 Prozent den größten Anteil an der weltweiten Verwendung von Aluminium aus.[76]
In Aluminiumlegierungen werden Festigkeiten erreicht, die denen von Stahl nur wenig nachstehen. Daher ist die Verwendung von Aluminium zur Gewichtsreduzierung überall dort angebracht, wo Materialkosten eine untergeordnete Rolle spielen. Insbesondere im Flugzeugbau und in der Weltraumtechnik sind Aluminium und Duraluminium weit verbreitet. Der größte Teil der Struktur heutiger Verkehrsflugzeuge wird aus Aluminiumblechen verschiedener Stärken und Legierungen genietet.
Fahrzeugbau
Bei Fahrzeugen spielt deren Masse eine Rolle: Je leichter ein Fahrzeug ist desto geringer ist der Treibstoffverbrauch. In Deutschland werden knapp 50 % des Aluminiums im Fahrzeugbau verwendet (Stand: 2015).[77]
- Autos
Bei Autos werden Aluminiumwerkstoffe verwendet für verschiedene Motorkomponenten – darunter der Motorblock, die Zylinderkolben für die spezielle Kolbenlegierungen existieren, die Zylinderköpfe – wo vor allem die geringe Wärmeausdehnung und Korrosionsanfäligkeit sowie die hohe Warmfestigkeit ausschlaggebend sind zusammen mit der guten Gießbarkeit da diese Komponenten üblicherweise gegossen werden. Weitere Anwendungen bei Fahrzeugen sind für Gehäuse von Getrieben, als Wärmeabschirmung und als Wärmetauscher – bei den letzten beiden in Form von Reinaluminium. Im Fahrwerk wird Aluminium genutzt als Schmiedeteile für Hinterachsen, Achsträger, Querlenker und Räder. In der Karosserie wird Aluminium verwendet für Türen, Motorhauben, Stoßfänger und Kotflügel, sowie in der Rohwagenstruktur.[78]
- Nutzfahrzeuge
Bei Nutzfahrzeugen wird Aluminium angewandt für Bordwände, Ladebordwände, Aufbauten, zur Ladungssicherung, Druckluftbehälter, Treibstofftanks und als Unterbauschutz. Der Leichtbau mit Aluminium wird bei Nutzfahrzeugen stark durch die gesetzliche Maximallast pro Achse beeinflusst: Bei geringerem Fahrzeuggewicht ist eine höhere Nutzlast möglich.[78]
- Schienenfahrzeuge
Auch bei Schienenfahrzeugen wird reichlich Aluminium verwendet. Voraussetzung waren dafür zwei wichtige andere Entwicklungen: Bestimmte Schweißverfahren die für Aluminiumwerkstoffe geeignet sind (WIG-Schweißen / MIG-Schweißen) in den 1950ern und das Strangpressen von Großprofilen. Die Verwendung von Aluminium hat die gesamte Bauweise von Schienenfahrzeugen verändert. Bis etwa 1970 waren Konstruktionen aus Stahlrohren üblich, danach vermehrt verschweißte Profile aus Aluminium.[79]
- Flugzeuge
Bereits in der Anfangsphase der Luftfahrt wurden Aluminiumwerkstoffe genutzt, 1903 beispielsweise Magnalium für die Beschläge eines Flugzeuges, das noch größtenteils aus Holz, Draht und Tuch bestand. Das erste flugfähige Ganzmetallflugzeug stammt aus dem Jahre 1915, bestand allerdings aus Stahlblechen in Schalenbauweise. Die entscheidende Entwicklung zur Verwendung von Aluminium im Flugzeugbau stammt von 1906 von Alfred Wilm, der mit dem Duraluminium eine aushärtbare Aluminium-Kupfer-Legierung fand, die sehr hohe Festigkeiten aufweist und sich daher ausgezeichnet für den Leichtbau eignet. Genutzt werden für Flugzeuge AlCu und AlZnMg. Die Gesamtmasse von Flugzeugen geht zu 60 % auf Aluminium zurück. Die Verbindung der aus Blechen gestanzten, geschnittenen oder getriebenen, aus dem Vollen gefrästen oder aus Profilen bestehenden Werkstücke erfolgt meist durch Nieten, da die meistverwendeten Werkstoffe schlecht schweißbar sind.[80]
Elektrotechnik
Elektrische Leitungen

Aluminium-Umguss am Käfigläufer-Blechpaket (zylindrisches Teil in der Mitte) eines Spaltpolmotors. Die Aluminium-Käfigstäbe verlaufen im Inneren. An den Stirnseiten sind zusätzlich Lüfterflügel mitgegossen. Obere Wicklung und Lagerschalen des Motors sind entfernt.
Aluminium ist ein guter elektrischer Leiter. Es weist nach Silber, Kupfer und Gold die vierthöchste elektrische Leitfähigkeit aller Metalle auf. Ein Leiter aus Aluminium hat bei gegebenem elektrischen Widerstand eine kleinere Masse, aber ein größeres Volumen als ein Leiter aus Kupfer. Daher wird meistens dann Kupfer als elektrischer Leiter verwendet, wenn das Volumen eine dominante Rolle spielt, wie beispielsweise bei den Wicklungen in Transformatoren. Aluminium hat dann als elektrischer Leiter Vorteile, wenn das Gewicht eine wesentliche Rolle spielt, beispielsweise bei den Leiterseilen von Freileitungen.[81] Aus dem Grund der Gewichtsreduktion werden auch in Flugzeugen wie dem Airbus A380 Aluminiumkabel verwendet.
Aluminium wird unter anderem auch zu Stromschienen in Umspannwerken und zu stromführenden Gussteilen verarbeitet. Für Elektroinstallationen gibt es kupferkaschierte Aluminiumkabel, der Kupferüberzug ist zur Verbesserung der Kontaktgabe. In diesem Anwendungsbereichen sind primär Rohstoffpreise entscheidend, da Aluminium preisgünstiger als Kupfer ist. Für Oberleitungen bei elektrischen Bahnen ist es dagegen aufgrund seiner schlechten Kontakt- und Gleiteigenschaften ungeeignet, in diesem Bereich wird trotz des höheren Gewichts primär Kupfer eingesetzt.
Beim Kontaktieren unter Druck ist Aluminium problematisch, da es zum Kriechen neigt. Außerdem überzieht es sich an Luft mit einer Oxidschicht. Nach längerer Lagerung oder Kontakt mit Wasser ist diese isolierende Schicht so dick, dass sie vor der Kontaktierung beseitigt werden muss. Vor allem im Kontakt mit Kupfer kommt es zu Bimetallkorrosion. Bei ungeeigneten Kontaktierungen in Klemmen kann es bei Aluminiumleitern in Folge zu Ausfällen und Kabelbränden aufgrund sich lösender Kontakte kommen. Crimpverbindungen mit passenden Hülsen und Werkzeugen sind jedoch sicher. Als Zwischenlage zwischen Kupfer und Aluminium können Verbindungsstücke aus Cupal die Kontaktprobleme vermeiden.
Hervorzuheben ist das geringe Absinken der spezifischen elektrischen Leitfähigkeit von Aluminium bei Zusatz von Legierungsbestandteilen, wohingegen Kupfer bei Verunreinigungen eine deutliche Verringerung der Leitfähigkeit zeigt.
Elektronik

Aluminium als Leitermaterial für Bonddrähte und Metallisierung in einem Bipolartransistor
Die Elektronikindustrie setzt Aluminium aufgrund der guten Verarbeitbarkeit und der guten elektrischen und Wärme-Leitfähigkeit ein.
In integrierten Schaltkreisen wurde bis in die 2000er-Jahre ausschließlich Aluminium als Leiterbahnmaterial eingesetzt. Bis in die 1980er-Jahre wurde es auch als Material für die Steuerelektrode (Gate) von Feldeffekttransistoren mit Metall-Isolator-Halbleiter-Struktur (MOSFET bzw. MOS-FET) verwendet.[82] Neben dem geringen spezifischen Widerstand sind für die Verwendung die gute Haftung auf und geringe Diffusion in Siliciumoxiden (Isolationsmaterial zwischen den Leiterbahnen) sowie die einfache Strukturierbarkeit mithilfe von Trockenätzen ausschlaggebend. Seit Anfang der 2000er-Jahre wird Aluminium jedoch zunehmend durch Kupfer als Leiterbahnmaterial ersetzt, auch wenn dafür aufwendigere Strukturierungsverfahren (vgl. Damascene- und Dual-Damascene-Prozess) und Diffusionsbarrieren notwendig sind.[83] Der höheren Fertigungsaufwand wird durch den geringeren spezifischen Widerstand, der im Fall von kleinen Strukturen bei Aluminium viel früher signifikant ansteigt[84] und anderen Eigenschaften (z. B. Elektromigrationverhalten) überwogen und die Aluminium-Prozesse konnte die gestiegenen Anforderungen (Taktfrequenz, Verlustleistung, etc.) in mit hohen Frequenzen arbeitenden Schaltkreisen nicht mehr genügen (siehe auch RC-Glied).
Aluminium wird jedoch weiterhin auch in mikroelektronischen Produkten verwendet, so wird es wegen seiner guten Kontaktierbarkeit durch andere Metalle in den letzten Leiterbahnebenen eingesetzt, um den elektrischen Kontakt zu den bei der Flip-Chip-Montage eingesetzten Lotkügelchen herzustellen. Ähnlich verhält es sich bei Leistungshalbleitern, bei denen in der Regel alle Leiterbahnebenen aus Aluminium bestehen. Allgemein und insbesondere bei Leistungshalbleitern wird das Material für Bonddrähte (Verbindungsdrähte zwischen Chip und Gehäuseanschluss) verwendet.
Mit der Einführung der High-k+Metal-Gate-Technik hat Aluminium nach gut 25 Jahren Abstinenz auch im Bereich des Gates an Bedeutung gewonnen und wird neben anderen als Material zur Einstellung der Austrittsarbeit eingesetzt.
Verpackung und Behälter

Eine klassische italienische Espressokanne aus Aluminium
In der Verpackungsindustrie wird Aluminium zu Getränke- und Konservendosen sowie zu Aluminiumfolie verarbeitet. Dabei macht man sich die Eigenschaft der absoluten Barrierewirkung gegenüber Sauerstoff, Licht und anderen Umwelteinflüssen zunutze. Ausschlaggebend für die Verwendung von Aluminium als Verpackung ist nicht die geringe Dichte, sondern die gute Verarbeitbarkeit durch Walzen und die Ungiftigkeit.[85] Dünne Folien werden in Stärken von sechs Mikrometern hergestellt und dann zumeist in Verbundsystemen eingesetzt, beispielsweise in Tetra Paks. Kunststofffolien können durch Bedampfen mit Aluminium mit einer dünnen Schicht versehen werden, welche dann eine hohe (aber nicht vollständige) Barrierefunktion aufweist. Grund dieser Barrierewirkung ist nicht das reine Aluminium, sondern die Passivschicht aus Böhmit. Wird diese verletzt, so kann Gas ungehindert durch den Werkstoff Aluminium strömen.[86][87] Genutzt werden meist Reinaluminium, AlMn (Legierungen mit Mangan) und AlMg (Legierungen mit Magnesium).[88]
Aus Aluminium werden auch Kochtöpfe und andere Küchengeräte, wie die klassische italienische Espressokanne, sowie Reise- und Militär-Geschirr hergestellt.
Aluminium wird für eine Vielzahl von Behältern und Gehäusen verarbeitet, da es sich gut durch Umformen bearbeiten lässt. Gegenstände aus Aluminium werden häufig durch eine Eloxalschicht vor Oxidation und Abrieb geschützt.
2017 entfielen 17 % der europäischen Aluminiumverwendung auf Verpackungen.[89]

Getränkedose
Optik und Lichttechnik

Reflexionsgrad von Aluminium (blau, Al) im Vergleich zu Gold (rot, Au) und Silber (grau, Ag)
Aluminium wird aufgrund seines hohen Reflexionsgrades als Spiegelbeschichtung von Oberflächenspiegeln, unter anderem in Scannern, Kraftfahrzeug-Scheinwerfern und Spiegelreflexkameras aber auch in der Infrarotmesstechnik eingesetzt. Es reflektiert im Gegensatz zu Silber auch Ultraviolettstrahlung.
Aluminium-Spiegelschichten werden meist durch eine Schutzschicht vor Korrosion und Kratzern geschützt.
Architektur und Bauwesen
Betonherstellung
Aluminiumpulver und Aluminiumpasten werden zur Herstellung von Porenbeton eingesetzt.[90] Man verwendet Verbindungen wie Aluminiumhydroxysulfat, Aluminiumdihydroxyformiat oder amorphes Aluminiumhydroxid als alkalifreie Spritzbetonbeschleuniger.[91]
Konstruktions- und Funktionswerkstoffe
Aluminium wird als Konstruktionswerkstoff verwendet für tragende Teile von Bauwerken und als Funktionswerkstoff als dekorative, korrisionsbeständige Teile. Neben der Witterungsbeständigkeit ist vor allem die gute Verarbeitbarkeit ausschlaggebend, insbesondere bei handwerklicher Fertigung. Das Baugewerbe ist der Hauptabnehmer für Aluminiumprofile. Genutzt wird Aluminium hauptsächlich für Fensterrahmen, Türen und Elemente von Fassaden. Besonders bekannt ist die Fassade des Imperial War Museums in Manchester. Genutzt werden vor allem die Aluminium-Mangan-Legierungen die geringe Festigkeit und gute Korrosionsbeständigkeit haben. Teilweise wird Aluminium auch für den Brückenbau angewandt, wo sonst der Stahlbau vorherrscht. Für den konstruktiven Ingenieurbau werden Legierungen mit höherer Festigkeit genutzt, darunter AlMg und AlSi.[92]
Bleche und Verbundplatten aus Aluminiumlegierungen erreichen Brandschutzklassen von 'nicht brennbar' bis 'normal entflammbar'.[93]
Ein Wohnungsbrand entwickelt im Vollbrand 1000 °C Hitze was ungeachtet der Brandschutzklasse Löcher in die Aluminiumlegierung brennt, die zwischen 600 °C und 660 °C nach unten fließt oder tropft.[9][94]

Das Imperial War Museum von Außen

Dachkonstruktion aus Aluminium beim Imperial War Museum

Aluminiumblech, punktuell über 600 °C erhitzt.
Weitere Anwendungen
In der Raketentechnik besteht der Treibstoff von Feststoffraketen zu maximal 30 Prozent aus Aluminiumpulver, das bei seiner Verbrennung viel Energie freisetzt.[95] Aluminium wird in Feuerwerken (s. a. Pyrotechnik) verwendet, wo es je nach Körnung und Mischung für farbige Effekte sorgt. Auch in Knallsätzen findet es oft Verwendung.[96]
Bei der Aluminothermie wird Aluminium zur Gewinnung anderer Metalle und Halbmetalle verwendet, indem das Aluminium zur Reduktion der Oxide genutzt wird. Ein wichtiges Verfahren der Aluminothermie ist die Thermitreaktion, bei der Aluminium mit Eisen(III)-oxid umgesetzt wird. Bei dieser stark exothermen Reaktion entstehen Temperaturen bis zu 2500 °C und flüssiges Eisen, das zum aluminothermischen Schweißen genutzt wird, z. B. zum Fügen von Bahngleisen. Weitere Anwendungen der Reduktionswirkung von Aluminium werden für Laborzwecke ermöglicht, indem Aluminiumamalgam verwendet wird.
Aluminium dient als Pigment für Farben (Silber- oder Goldbronze). Farbig eloxiert ist es Bestandteil vieler Dekorationsmaterialien wie Flitter, Geschenkbänder und Lametta. Zur Beschichtung von Oberflächen wird es beim Aluminieren verwendet.
Mit Aluminium werden Heizelemente von Bügeleisen und Kaffeemaschinen umpresst.
Bevor es gelang, Zinkblech durch Titanzusatz als so genanntes Titanzink verarbeitbar zu machen, wurde Aluminiumblech für Fassaden- und Dachelemente (siehe Leichtdach) sowie Dachrinnen eingesetzt.
Wegen seiner hohen Wärmeleitfähigkeit wird Aluminium als Werkstoff für stranggepresste Kühlkörper und wärmeableitende Grundplatten verwendet. Aluminium-Elektrolytkondensatoren verbauen Aluminium als Elektrodenmaterial und Gehäusewerkstoff, weiters wird es zur Herstellung von Antennen und Hohlleitern verwendet.
Aluminium kommt in einigen Legierungen vor. Neben den Aluminiumlegierungen die überwiegend aus Aluminium bestehen, kommt es noch vor in den Kupferlegierungen Aluminiumbronze, Aluminiummessing, Isabellin, zu etwa gleichen Teilen Al und Kupfer in der Devardaschen Legierung, als Hauptlegierungselement für Magnesiumlegierungen sowie in Alnico und Sendust, zwei Eisenlegierungen mit besonderen magnetischen Eigenschaften. In vielen Titanlegierungen kommt ebenfalls Aluminium vor, insbesondere in Ti-6Al-4V, der Sorte die etwa 50 % aller Titanlegierungen ausmacht.[97] Dort ist Aluminium mit 6 Massenprozent enthalten.
Verarbeitung
Bei der Verarbeitung wird unterschieden, ob es sich um Gusslegierungen handelt oder um Knetlegierungen:
- Gusslegierungen werden in Gießereien verarbeitet und in Formen gegossen, die schon vollständig oder weitgehend der Form der Endprodukte entsprechen. Danach erfolgt eine Endbearbeitung durch Schleifen. Gusslegierungen werden häufig aus Schrott erschmolzen.
- Knetlegierungen werden in den Hüttenwerken zu Barren vergossen und anschließend dort gewalzt, um Platten, Bleche, Stangen und Folien herzustellen. Aus dicken Platten und anderen massiven Rohteilen werden durch Zerspanen (Fräsen, Bohren und Drehen) Einzelteile hergestellt. Andere massive Rohteile können durch Schmieden zu Einzelstücken verarbeitet werden oder durch Strangpressen zu Profilen. Letzteres kommt bei Aluminium besonders häufig vor. Bleche werden durch Stanzen, Biegen und Tiefziehen verarbeitet.
Danach werden die Einzelteile verbunden durch Schweißen, Nieten, Löten und ähnliche Verfahren.
Gießen

Gießen von Aluminium

Datenschieber für den Aluminiumguss
Das Gießen von Aluminium wird als Aluminiumguss bezeichnet. Es gehört aufgrund seines vergleichsweise geringen Schmelzpunktes von 660 °C (Gusseisen etwa 1150 °C, Stahl 1400 °C bis 1500 °C) und seiner guten Gießbarkeit zu den häufig in der Gießerei verwendeten Werkstoffen. AlSi, spezielle Gusslegierungen mit Silicium, haben sogar Schmelzpunkte um 577 °C.[98] Der Massenanteil von Aluminium aller in Gießereien erzeugten Produkte beträgt etwa 11 % (Gusseisen 76 %, Stahlguss 9 %) und ist damit in der Gießerei das mit Abstand wichtigste Nichteisenmetall (NE-Metalle) noch vor Kupfer mit 1,5 %.[99] Der Anteil am NE-Metallguss von Aluminium beträgt etwa 87 %. In Deutschland wurden 2011 etwa 840.000 Tonnen Aluminium in Gießereien verarbeitet; Etwa 76 % des Nichteisenmetall-Gusses wird von der Automobilbranche abgenommen.[100]
Aus dem niedrigen Schmelzpunkt folgt ein geringer Energieeinsatz beim Schmelzvorgang sowie eine geringere Temperaturbelastung der Formen.[101]
Aluminium eignet sich grundsätzlich für alle Gussverfahren, insbesondere für Druckguss bzw. Aluminiumdruckguss, mit denen auch kompliziert geformte Teile gefertigt werden können. In der Gießerei werden besondere Aluminiumgusslegierungen verarbeitet, größtenteils die Aluminium-Silicium-Legierungen. In den Hüttenwerken werden dagegen meist Knetlegierungen erzeugt, die zur Weiterbearbeitung durch Walzen, Schmieden und Fließpressen gedacht sind. Diese werden in den Hüttenwerken vergossen zu Barren (Blockguss) oder zu Rundbarren, die theoretisch endlos sein können (Strangguss). Seit den 1930er-Jahren kommt der Strangguss vermehrt zum Einsatz. Dafür gibt es spezielle Anlagen die bis zu 96 Rundbarren gleichzeitig herstellen können mit Gießlängen zwischen 3 und 7 Metern teils bis zu 10 Metern. Die Durchmesser liegen bei 75 bis 700 mm. Bleche werden manchmal hergestellt durch Gießen direkt auf eine Walze die die Schmelze kühlt. Das Rohblech wird danach direkt kaltgewalzt ohne Warmwalzen, was Kosten von bis zu 60 % spart.[102]
Umformende Verfahren
Etwa 74 Prozent des Aluminiums wird durch Umformen bearbeitet.[103] Hierzu zählt unter anderem das Walzen, Schmieden, Strangpressen und Biegen.
Rein- und Reinstaluminium lässt sich wegen der niedrigen Festigkeit gut umformen und verfestigt sich bei Kaltumformung, wobei große Formänderungen möglich sind. Die Verfestigung lässt sich durch Rekristallisationsglühen beseitigen. Knetlegierungen mit AlMg und AlMn erreichen ihre höhere Festigkeit durch die Legierungselemente und durch Kaltverformung. Die aushärtbaren Legierungen AlMgSi, AlZnMg, AlCuMg und AlZnMgCu scheiden bei Umformung festigkeitssteigernde Phasen aus; sie lassen sich relativ schwierig umformen.[104]
- Walzen
Gegossene Barren werden häufig durch Walzen weiterverarbeitet, entweder zu dicken Platten die anschließend durch Fräsen zu Endprodukten werden, zu Blechen die durch Stanzen und Biegen weiterverarbeitet werden oder zu Folien. Beim Walzen ändert sich die Mikrostruktur der Werkstoffe: Kleine kugelförmige Bestandteile die häufig nach dem Gießen vorliegen, werden plattgedrückt und in die Länge gezogen. Das Gefüge wird dadurch einerseits feiner und gleichmäßiger, andererseits aber auch Richtungsabhängig. Die Kapazität einer Aluminium-Warmwalzanlage liegt bei etwa 800.000 Tonnen pro Jahr. Verarbeitet werden Barren mit bis zu 30 Tonnen Masse. Sie haben Abmessungen von bis zu 8,7 Metern Länge, 2,2 Metern Breite und 60 cm Dicke. Noch größere Barren können technisch verarbeitet werden, die Gefügequalität nimmt dann aber ab. Nach dem Warmwalzen liegt der Werkstoff meist mit Dicken von etwa 20 bis 30 mm vor. Anschließend folgt das Kaltwalzen auf Enddicke. Kaltwalzwerke haben Kapazitäten von 300.000 bis 400.000 Jahrestonnen. Verbundwerkstoffe können durch Walzplattieren hergestellt werden. Dabei wird ein- oder zweiseitig eine Schicht aus einem anderen Werkstoff aufgebracht. Häufig wird auf korrosionsanfälliges Kernmaterial eine Schicht aus korrosionsbeständigem Reinaluminium aufgebracht.[105]
- Strangpressen

Stranggepresste Aluminium-Profile
Aluminium lässt sich durch Strangpressen in komplizierte Konstruktionsprofile formen; hierin liegt ein großer Vorteil bei der Fertigung von Hohlprofilen (z. B. für Fensterrahmen, Stäbe, Balken), Kühlkörperprofilen oder in der Antennentechnik. Die Herstellung von Halbzeug oder Bauteilen geschieht aus Vormaterial wie etwa Walzbarren, Blech oder Zylindern. Aluminiumlegierungen lassen sich deutlich besser strangpressen als andere Werkstoffe, weshalb ein großer Teil des Aluminiums mit diesem Verfahren verarbeitet wird. Dabei wird das Ausgangsmaterial durch ein hohles Werkzeug gepresst. Es entsteht Endlosmaterial das in der gewünschten Länge abgesägt wird. Es können auch komplizierte Querschnitte hergestellt werden, beispielsweise Hohlprofile oder welche mit Hinterschneidungen. Der Querschnitt ist allerdings über die Länge konstant. Mit hochfesten Legierungen sind große Mindestwanddicken erforderlich und das Pressen dauert lange, weshalb eher die mittelfesten, aushärtbaren Legierungen bevorzugt werden. Die Aushärtung wird meist direkt im Anschluss durchgeführt. Beim Strangpressen wird der Werkstoff auf Temperaturen von etwa 450 bis 500 °C erwärmt um die Umformbarkeit zu erhöhen, was gleichzeitig zum Lösungsglühen genutzt wird. Direkt nach dem Strangpressen wird das Werkstück durch Luft oder Wasser starkt abgekühlt und so abgeschreckt was zu höheren Festigkeiten führt.[106]
- Sonstige
Ein Mischverfahren aus Gießen und Schmieden ist Cobapress, welches speziell für Aluminium ausgelegt ist und häufig in der Automobilbranche genutzt wird. Moderne Walzwerke sind sehr teuer, aber auch sehr produktiv.
Spanende Verfahren

Drehen von Aluminium
Zum Zerspanen zählt das Drehen, Bohren und Fräsen. Aluminiumwerkstoffe sind gut spanbar.[107] Ihre genauen Eigenschaften hängen jedoch von der Legierung und Gefügezustand ab. Zu beachten ist, dass die bei der Bearbeitung auftretenden Temperaturen schnell im Bereich des Schmelzpunktes liegen können. Bei gleichen Schnittparametern wie bei Stahl resultiert bei Aluminium allerdings eine geringere mechanische und thermische Belastung. Als Schneidstoff wird oft Hartmetall für untereutektische oder Diamant für die stark verschleißenden übereutektischen Legierungen verwendet.[108]
Insbesondere die Bearbeitung von eloxierten Werkstücken erfordert harte Werkzeuge, um Verschleiß durch die harte Eloxalschicht zu vermeiden. Die beim Schleifen von Aluminium entstehenden Schleifstäube können zu einem erhöhten Explosionsrisiko führen.[109]
Schweißen und Löten
Grundsätzlich sind alle Aluminium-Werkstoffe zum Schweißen geeignet, wobei jedoch reines Aluminium zu Poren in der Schweißnaht neigt.[110] Außerdem neigt die Aluminiumschmelze zu Reaktionen mit der Atmosphäre, weshalb fast immer unter Schutzgas geschweißt wird. Gut geeignet sind das MIG- und Plasmaschweißen sowie das WIG-Schweißen. Bei Letzterem wird bei Nutzung von Wechselstrom das Edelgas Argon als Schutzgas verwendet, und bei Gleichstrom Helium.
Für das Laserschweißen eignen sich sowohl Kohlendioxid- als auch Festkörperlaser, allerdings nicht für alle Legierungen. Wegen der hohen Wärmeleitfähigkeit erstarrt die Schmelze sehr schnell, sodass die Schweißnaht zu Poren und Rissen neigt. Das Widerstandspunktschweißen erfordert, verglichen mit Stahl, höhere elektrische Ströme und kürzere Schweißzeiten sowie teilweise spezielle Geräte, da die handelsüblichen Schweissgeräte für Stahl nicht dafür geeignet sind. Für das Elektronenstrahlschweißen eignen sich alle Legierungen, jedoch neigen Magnesium und Zinn zum Verdampfen während des Schweißvorgangs.[111]Lichtbogenhandschweißen wird nur noch selten verwendet, meist zur Gussnachbesserung. Löten gestaltet sich wegen der sich bildenden Oxidschicht an Luft schwierig. Genutzt werden sowohl Hart- als auch Weichlöten mit speziellen Flussmitteln. Alternativ kann Aluminium auch ohne Flussmittel mit Ultraschall gelötet werden, dabei wird die Oxidschicht mechanisch während des Lötvorganges aufgebrochen.
Aluminium in Natur und Organismen
Aluminium im menschlichen Körper
Aluminium ist kein essentielles Spurenelement und gilt für die menschliche Ernährung als entbehrlich.[112] Im menschlichen Körper befinden sich durchschnittlich etwa 50 bis 150 Milligramm Aluminium.[113] Diese verteilen sich zu ungefähr 50 Prozent auf das Lungengewebe, zu 25 Prozent auf die Weichteile und zu weiteren 25 Prozent auf die Knochen. Aluminium ist damit ein natürlicher Bestandteil des menschlichen Körpers.
99 bis 99,9 Prozent der üblicherweise in Lebensmitteln aufgenommenen Menge von Aluminium (10 bis 40 mg pro Tag) werden unresorbiert über den Kot wieder ausgeschieden. Chelatbildner (Komplexbildner) wie Citronensäure können die Resorption auf 2 bis 3 Prozent steigern. Auch die Aufnahme von Aluminiumsalzen über den Magen-Darm-Trakt ist gering; sie variiert aber in Abhängigkeit von der chemischen Verbindung und ihrer Löslichkeit, dem pH-Wert und der Anwesenheit von Komplexbildnern. Man schätzt, dass 1 ‰ bzw. 3 ‰ des in der Nahrung bzw. im Trinkwasser erhaltenen Aluminiums im Magen-Darm-Trakt absorbiert werden.[114] Die Eliminierung von in den Organismus gelangten wasserlöslichen Aluminiumsalzen erfolgt innerhalb weniger Tage vorwiegend über den Urin, weniger über den Kot. Bei Dialysepatienten mit einer eingeschränkten Nierenfunktion besteht daher ein erhöhtes Risiko einer Akkumulation im Körper mit toxischen Effekten, etwa Knochenerweichungen und Schäden des Zentralnervensystems; zusätzlich sind Dialysepatienten aufgrund für sie notwendiger pharmazeutischer Produkte (Phosphatbinder) einer höheren Aluminiumzufuhr ausgesetzt.[113] Aluminium, das nicht über die Nieren ausgeschieden wird, gelangt in die Knochen.[114] Dort wird es vergleichsweise sehr langsam eliminiert.
Im Blut ist Al3+ überwiegend (zu etwa 80 %) an Transferrin gebunden. 16 Prozent liegen als [Al(PO4)(OH)]−, 1,9 Prozent als Citrat-Komplex, 0,8 Prozent als Al(OH)3 und 0,6 Prozent als [Al(OH)4]− vor.[115]
Pflanzen
Aluminium in Form verschiedener Salze (Phosphate, Silikate) ist Bestandteil vieler Pflanzen und Früchte, denn gelöste Al-Verbindungen werden durch Regen aus den Böden von den Pflanzen aufgenommen, bei Säurebelastung der Böden infolge sauren Regens[116] ist dies vermehrt der Fall (siehe dazu auch Waldschäden).
Ein großer Teil des Bodens auf der Welt ist chemisch sauer. Liegt der pH-Wert unter 5,0, werden Al3+-Ionen von den Wurzeln der Pflanzen aufgenommen. Dies ist bei der Hälfte des bebaubaren Lands auf der Welt der Fall. Die Ionen schädigen insbesondere das Wurzelwachstum der Feinwurzeln. Die Pflanze, wenn sie nicht Aluminium-tolerant ist, steht dann unter Stress. Zahlreiche Enzyme und signalübertragende Proteine sind betroffen; die Folgen der Vergiftung sind noch nicht vollständig bekannt. In sauren metallhaltigen Böden ist Al3+ das Ion mit dem größten Potenzial zur Schädigung. Von der Modellpflanze Arabidopsis sind Transgene bekannt, die deren Aluminium-Toleranz heraufsetzen und auch bei Kulturpflanzen sind tolerante Sorten bekannt.[117][118][119][120]
Der saure Regen hat beispielsweise in Schweden in den 1960er-Jahren die Seen übersäuert, wodurch mehr Al3+-Ionen in Lösung gingen und empfindliche Fische verendeten.[115] Auch in Norwegen wurde dieser Zusammenhang bei einem Forschungsprojekt in den 1970er-Jahren festgestellt.[121]
Bei pH-Werten über 5,0 ist Aluminium als polymeres Hydroxykation an der Oberfläche von Silicaten gebunden. Bei pH-Werten von 4,2 bis 5 steigt Anteil von mobilen Kationen.
Bei Erhöhung der Schwefelsäurekonzentration durch sauren Regen bildet sich Aluminiumhydroxysulfat:[115]
- Al(OH)3+ H2SO4→Al(OH)SO4+2 H2O{displaystyle mathrm {Al(OH)_{3}+ H_{2}SO_{4}rightarrow Al(OH)SO_{4}+2 H_{2}O} }
In Lebensmitteln
| Lebensmittel | Gehalt[122] in mg/kg |
|---|---|
| Tee (Trockenerzeugnisse) | 385 |
| Kakao und Schokolade | 100 |
| Salatarten | 28,5 |
| Hülsenfrüchte | 22,5 |
| Getreide | 13,7 |
| Pilzkonserven | 9,3 |
| Kohlarten | 9,0 |
| Wurstwaren | 7,8 |
| Gemüsekonserven | 7,6 |
| Obstkonserven | 3,6 |
| Fische und Fischerzeugnisse | 3,3 |
| Obst | 3,1 |
| Kindernahrung | 3,0 |
| Käse | 2,9 |
| Frischpilze | 2,7 |
| Paprika, Gurken, Tomaten, Melonen | 2,2 |
| Kartoffeln | 2,1 |
| Fleisch | 1,2 |
Die meisten Lebensmittel enthalten in Spurenmengen auch Aluminium. Unverarbeitete pflanzliche Lebensmittel enthalten durchschnittlich weniger als 5 mg/kg in der Frischmasse. Dabei streuen die Werte aufgrund unterschiedlicher Sorten, Anbaubedingungen und Herkunft in erheblichem Maße.[123] So weisen beispielsweise Salat und Kakao deutlich höhere Durchschnittswerte auf. Schwarzer Tee kann Gehalte von bis zu 1042 mg/kg in der Trockenmasse aufweisen.[124]
Beim Kochen oder Aufbewahren in Aluminiumgeschirr oder in Alufolie kann es (außer bei sauren Lebensmitteln) nach einer Schätzung zu einer maximalen zusätzlichen Aufnahme von 3,5 mg/Tag/Person kommen. Bei sauren Lebensmitteln wie Sauerkraut oder auch Tomaten können aufgrund der Säurelöslichkeit wesentlich höhere Werte erreicht werden.[125]
Trink- und Mineralwässer weisen mit durchschnittlich 0,2–0,4 mg/l im Gegensatz zur Nahrung geringe Gehalte auf und stellen somit nur einen kleinen Beitrag zur täglichen Aluminium-Aufnahme.[123][125] Die Trinkwasserverordnung legt einen Grenzwert von 0,2 mg/l fest. Trinkwasser darf in Deutschland, Österreich und der Schweiz keine höheren Werte aufweisen.
Nach einer Schätzung nimmt der erwachsene Europäer im Durchschnitt zwischen 1,6 und 13 mg Aluminium pro Tag über die Nahrung auf.[114] Dies entspricht einer wöchentlichen Aufnahme von 0,2 bis 1,5 mg Aluminium pro kg Körpergewicht bei einem 60 kg schweren Erwachsenen. Die großen Unsicherheiten beruhen auf den unterschiedlichen Ernährungsgewohnheiten und der variablen Gehalte an Aluminium in den Lebensmitteln[123], auch innerhalb eines Landes aufgrund verschiedener Erhebungen.[114]
Die Europäische Behörde für Lebensmittelsicherheit (Efsa) legt eine tolerierbare wöchentliche Aufnahme (TWI) von 1 mg Aluminium pro kg Körpergewicht fest.[126]
Aluminium ist als Lebensmittelzusatzstoff unter der Bezeichnung E 173 ausschließlich als Farbmittel für Überzüge von Zuckerwaren und als Dekoration von Kuchen und Keksen erlaubt. Weiterhin ist Aluminium zum Färben von Arzneimitteln und Kosmetika zugelassen.[127]
Bei der Untersuchung von Laugengebäck (Brezeln, Stangen, Brötchen) aus Bäckereien wurde Aluminium nachgewiesen, das in das Lebensmittel gelangt, wenn bei der Herstellung von Laugengebäck Aluminiumbleche verwendet werden.[128]
Während Bier in Aluminiumfässern transportiert wird, hat sich für den Weintransport der Werkstoff Aluminium nicht durchgesetzt. Ein kurzfristiger Kontakt schadet nicht, doch können nach längerem Kontakt Weinfehler in Geruch und Geschmack oder als Trübung auftreten, vor allem beim offenen Stehen an der Luft.[129]
Toxizität
Bei eingeschränkter Nierenfunktion und bei Dialyse-Patienten führt die Aufnahme von Aluminium zu progressiver Enzephalopathie (Gedächtnis- und Sprachstörungen, Antriebslosigkeit und Aggressivität) durch Untergang von Hirnzellen und zu fortschreitender Demenz, zu Osteoporose (Arthritis) mit Knochenbrüchen und zu Anämie[130] (weil Aluminium dieselben Speichereiweiße wie Eisen besetzt).
Speziell im Hinblick auf die Verwendung in Deodorants und Lebensmittel-Zusatzstoffen werden die gesundheitlichen Auswirkungen von Aluminium kontrovers diskutiert.[131][132] So wurde Aluminium mehrfach kontrovers als Faktor im Zusammenhang mit der Alzheimer-Krankheit in Verbindung gebracht.[132][133]
Laut einer Studie des Bundesinstituts für Risikobewertung (BfR) vom Juli 2007 wurde im allgemeinen Fall zum Zeitpunkt der Erstellung der Studie aufgrund der vergleichsweise geringen Menge kein Alzheimer-Risiko durch Aluminium aus Bedarfsgegenständen erkannt; jedoch sollten vorsorglich keine sauren Speisen in Kontakt mit Aluminiumtöpfen oder -folie aufbewahrt werden.[125] Eine Neubewertung erfuhr im Februar 2014 die Verwendung von aluminiumhaltigen Deodorants und Kosmetikartikel durch das Bundesinstitut für Risikobewertung: Aluminiumsalze aus solchen Produkten können durch die Haut aufgenommen werden, und die regelmäßige Benutzung über Jahrzehnte hinweg könnte möglicherweise zu gesundheitlichen Beeinträchtigungen beitragen.[134]
Die britische Alzheimer-Gesellschaft mit Sitz in London vertritt den Standpunkt, dass die bis 2008 erstellten Studien einen kausalen Zusammenhang zwischen Aluminium und der Alzheimer-Krankheit nicht überzeugend nachgewiesen haben.[135] Dennoch gibt es einige Studien, wie z. B. die PAQUID-Kohortenstudie in Frankreich, mit einer Gesundheitsdatenauswertung von 3777 Personen im Alter ab 65 Jahren seit 1988 bis zur Gegenwart,[136] in welchen eine Aluminium-Exposition als Risikofaktor für die Alzheimer-Krankheit angegeben wird. Demnach wurden viele senile Plaques mit erhöhten Aluminium-Werten in Gehirnen von Alzheimer-Patienten gefunden. Es ist jedoch unklar, ob die Aluminium-Akkumulation eine Folge der Alzheimer-Krankheit ist, oder ob Aluminium in ursächlichem Zusammenhang mit der Alzheimer-Krankheit zu sehen ist.[137]
Aluminium gehört zu den nicht essentiellen Spurenelementen, bei der Toxizität kommt es im Wesentlichen auf die Menge an: 0,01 mg/l Aluminium im Blut gilt als Normalwert, Werte über 0,06 mg/l sprechen für übermäßige Belastung und Werte über 0,2 mg/l im Blut gelten als toxisch.[138]
Aspekte der Ökobilanz

Aluminiumschaum

Recycling-Code für Aluminium
Die Herstellung von Aluminium ist sehr energieaufwendig. Allein für die Schmelzflusselektrolyse zur Gewinnung eines Kilogramms Aluminium werden je nach Errichtungsdatum und Modernität der Anlage zwischen 12,9 und 17,7 kWh elektrische Energie benötigt.[37] Bei der Stromerzeugung für die Produktion von einem Kilogramm Aluminium werden im deutschen Kraftwerkspark 8,4 kg CO2 freigesetzt, im weltweiten Durchschnitt etwa 10 kg. Es ist aber auch zu bedenken, dass aufgrund des Kostenfaktors Energie die Elektrolyse verstärkt an Orten erfolgt, an denen auf billige, CO2-emissionsarme Wasserkraft zurückgegriffen werden kann, wie etwa in Brasilien, Kanada, Venezuela oder Island.[139] Allerdings ist auch bei Verwendung von Elektrizität aus vollständig regenerativen Energien die Produktion von Aluminium nicht CO2-frei, da der bei der Schmelzflusselektrolyse entstehende Sauerstoff mit dem Kohlenstoff der Elektroden zu CO2 reagiert. Die Verbrauchswerte für Roh-Aluminium erhöhen sich durch Transport- und Verarbeitungsanteile für das Wiederaufschmelzen, Gießen, Schleifen, Bohren, Polieren etc. auf ca. 16,5 kg CO2 pro kg Aluminium-Konsumgut.[140]
Die europaweite Recyclingrate von Aluminium liegt bei 67 Prozent. In Österreich gelangen (laut einer Studie aus dem Jahr 2000)[141] 16.000 Tonnen Aluminium pro Jahr über Verpackungen in den Konsum, ebenso gelangen 16.000 Tonnen Aluminium ohne Wiederverwertung in den Hausmüll (dabei sind unter anderem auch die Aluminiumhaushaltsfolien eingerechnet, die nicht als „Verpackung“ gelten). 66 Prozent der Verpackungen im Restmüll sind Aluminium[getränke]dosen. Diese liegen nach der Müllverbrennung in der Asche noch metallisch vor und machen in Europa durchschnittlich 2,3 Prozent der Asche aus.[142] In der EU werden durchschnittlich 70 Prozent des in der Bodenasche enthaltenen Aluminiums zurückgewonnen.[143]
Durch den Abbau des Erzes Bauxit werden große Flächen in Anspruch genommen, die erst nach einer Rekultivierung wieder nutzbar werden. Um eine Tonne Aluminium herzustellen, werden vier Tonnen Bauxit benötigt. Dies erzeugt zehn Tonnen Abraum.[144] Zudem entstehen bei der Herstellung des Aluminiumoxids nach dem Bayer-Verfahren ca. drei Tonnen von eisenreichem alkalischen Rotschlamm,[145] der kaum wiederverwertet wird und dessen Deponierung oder sonstige „Entsorgung“ große Umweltprobleme aufwirft (siehe entsprechende Abschnitte unter Rotschlamm und Bauxitbergbau in Australien).
Positiv ist hingegen die gute Wiederverwendbarkeit von Aluminium hervorzuheben, wobei die Reststoffe streng getrennt erfasst und gereinigt werden müssen (Aluminiumrecycling, Recycling-Code-41 (ALU)). Aluminium ist dabei besser rezyklierbar als Kunststoffe, wegen Downcycling bei nicht sortenreiner Erfassung jedoch etwas schlechter wiederverwertbar als Stahl. Beim Aluminiumrecycling wird nur 5 Prozent der Energiemenge der Primärproduktion benötigt.[146]
Durch Leichtbau mit Aluminiumwerkstoffen (beispielsweise Aluminiumschaum, Strangpressprofile) wird Masse von beweglichen Teilen und Fahrzeugen gespart, was zur Einsparung von Treibstoff führen kann.
Aluminium ist durch seine Selbstpassivierung korrosionsbeständiger als Eisen und erfordert daher weniger Korrosionsschutzmaßnahmen.
Nachweis
Aluminiumsalze weist man durch Glühen mit verdünnter Kobaltnitratlösung (Co(NO3)2) auf der Magnesia-Rinne nach. Dabei entsteht das Pigment Thénards Blau, ein Cobaltaluminiumspinell mit der Formel CoAl2O4. Es wird auch Kobaltblau oder Cobaltblau, Dumonts Blau, Coelestinblau, Cobaltaluminat oder – nach dem Entdecker des Pigments, Josef Leithner, – Leithners Blau genannt.
Nachweis mittels Kryolithprobe
Die Probelösung wird alkalisch gemacht, um Aluminium als Aluminiumhydroxid Al(OH)3 zu fällen. Der Niederschlag wird abfiltriert und mit einigen Tropfen Phenolphthalein versetzt, dann gewaschen, bis keine Rotfärbung durch Phenolphthalein mehr vorhanden ist. Anschließend festes Natriumfluorid (NaF) auf den Niederschlag streuen: Es bildet sich eine Rotfärbung durch Phenolphthalein, verursacht von freigesetzten Hydroxidionen bei der Bildung von Kryolith Na3[AlF6].
Nachweis als fluoreszierender Morinfarblack

Strukturformel der Al(III)-Morin-Reaktion
Die Probe wird mit Salzsäure (HCl) versetzt und eventuell vorhandenes Aluminium somit gelöst. Anschließend wird die Probelösung mit Kaliumhydroxid (KOH) stark alkalisch gemacht. Gibt man nun einige Tropfen der Probelösung zusammen mit der gleichen Menge Morin-Lösung auf eine Tüpfelplatte und säuert anschließend mit konzentrierter Essigsäure (Eisessig, CH3COOH) an, so ist unter UV-Strahlung (λ = 366 nm) eine grüne Fluoreszenz beobachtbar. Der Nachweis ist dann sicher, wenn diese Fluoreszenz bei Zugabe von Salzsäure wieder verschwindet.[147]
Grund hierfür ist, dass Al(III) in neutralen sowie essigsauren Lösungen in Verbindung mit Morin eine fluoreszierende kolloidale Suspension bildet.
Verbindungen
Aluminiumoxid Al2O3 (englisch alumina), auch als Tonerde oder Korund bekannt, liegt als weißes Pulver oder in Form sehr harter Kristalle vor. Es ist das Endprodukt des Bayer-Verfahrens und dient in erster Linie als Ausgangsmaterial für die Aluminiumgewinnung (Schmelzflusselektrolyse). Es wird darüber hinaus als Schleif- oder Poliermittel und für Uhrensteine, Ziehsteine und Düsen verwendet. In keramischer Form dient es als Isolierstoff, Konstruktionskeramik, als Substratmaterial für Dickschichtschaltkreise, als Grundplatte von Leistungshalbleitern und in transparenter Form als Entladungsgefäß von Natriumdampf-Hochdrucklampen.
Aluminiumhydroxid Al(OH)3 wird ebenfalls nach dem Bayer-Verfahren gewonnen und ist das wichtigste Ausgangsmaterial zur Erzeugung anderer Al-Verbindungen, vor allem für Aluminate. Als reines Produkt wird es als Füllstoff und zum Brandschutz in Kunststoffen und Beschichtungen eingesetzt.
Aluminiumchlorid, Polyaluminiumchlorid und Aluminiumsulfat werden vor allem als Flockungsmittel in der Wasseraufbereitung, Abwasserreinigung und der Papierindustrie eingesetzt.
Natriumaluminat NaAl(OH)4 wird ebenfalls als Flockungsmittel verwendet und ist weiterhin Rohstoff für die Zeolith-Produktion, Titandioxid-Beschichtung und Calciumaluminatsulfat-Herstellung.
Zeolithe (Alumosilikate) als Ionenaustauscher, in Lebensmitteln und in Waschmitteln zur Wasserenthärtung.
Alaune (Kaliumaluminiumsulfat, KAl(SO4)2·12H2O). Wegen seiner adstringierenden Wirkung als Rasierstift eingesetzt zum Stillen von kleinen Blutungen.
Aluminiumdiacetat, bekannt als essigsaure Tonerde für entzündungshemmende Umschläge.
Aluminiumorganische Verbindungen wie etwa Triethylaluminium werden im großtechnischen Maßstab als Katalysatoren in der Polyethylen-Herstellung eingesetzt. Ein weiteres Anwendungsgebiet ist die Halbleitertechnik. Hier werden flüchtige Aluminiumalkyle (Trimethylaluminium, Triethylaluminium etc.) als Vorstufen zur CVD (chemical vapor deposition) von Aluminiumoxid verwendet, das man als Isolator und Ersatz für das nicht ausreichend isolierende Siliciumdioxid einsetzt.
Aluminiumoxynitrid ist ein transparenter keramischer Werkstoff.
Aluminiumnitrid ist ein Konstruktions- und Isolationswerkstoff und zeichnet sich durch sehr hohe Wärmeleitfähigkeit bei Raumtemperatur aus. Außerdem könnte die hohe Bandlücke die Anwendung als Wide-Bandgap-Halbleiter ermöglichen.
Lithiumaluminiumhydrid (LiAlH4) ist ein starkes Reduktionsmittel, welches weitverbreitet bei der Synthese organischer Verbindungen ist.
Phosphate: Aluminiumphosphate sind Aluminiumsalze der Phosphorsäure. Aufgrund der Eigenschaft der Phosphorsäure beziehungsweise des Phosphat-Anions (PO43−), unter bestimmten Bedingungen Wasser abzuspalten und infolgedessen zu polymerisieren, sind verschiedene Aluminiumphosphate bekannt:
Aluminiumorthophosphat (AlPO4)
Aluminiummetaphosphat (Al(PO3)3)- Monoaluminiumphosphat (Al(H2PO4)3)
- Aluminiumpolyphosphat
- In der Natur treten Aluminiumphosphate meist in Form von Doppelsalzen auf. Beispiele hierfür sind etwa der Wavellit (Al3(PO4)2(F, OH)3 · 5H2O) oder der Türkis, ein Mischphosphat aus Kupfer und Aluminium/Eisen: Cu(Al,Fe)6(PO4)4(OH)8 · 4 H2O.
Unter besonderen Bedingungen tritt Aluminium auch einwertig auf. Diese Verbindungen werden zur Gewinnung von hochreinem Aluminium genutzt (Subhalogeniddestillation).
Siehe auch
- Liste der Aluminiumhütten
- Liste der größten Aluminiumproduzenten
Literatur
- Zur Geschichte
Hans Joliet (Hrsg.): Aluminium – Die ersten hundert Jahre. VDI Verlag, 1988, ISBN 3-18-400802-9.
- Deutsche Fachliteratur
- Friedrich Ostermann: Anwendungstechnologie Aluminium. 3. Auflage. Springer, 2014, ISBN 978-3-662-43806-0.
Aluminium-Taschenbuch. Aluminium-Verlag, Düsseldorf:
- Band 1: Grundlagen und Werkstoffe, 16. Auflage, 2002.
- Band 2: Umformen von Aluminium-Werkstoffen, Gießen von Aluminium-Teilen, Oberflächenbehandlung von Aluminium, Recycling und Ökologie, 15. Auflage 1999, 672 S.
- Band 3: Weiterverarbeitung und Anwendung, 16. Auflage, 2003, 863 S.
- Luitgard Marschall: Aluminium. Metall der Moderne. Oekom, München 2008, ISBN 978-3-86581-090-8.
- Englische Fachliteratur
- George E. Totten, D. Scott MacKenzie: Handbook of Aluminum. Marcel Dekker, Yew York, Basel:
- Band 1: Physical Metallurgy and Processes. 2003, 1296 S.
- Band 2: Alloy Production and Materials Manufacturing. 2003, 724 S.
- Joseph R. Davis (Hrsg.): Aluminum and Aluminum Alloys. 4. Auflage, 1998, 784 S.
Weblinks
MATERIAL ARCHIV: Aluminium – Umfangreiche Materialinformationen und Bilder.- Newsseite des Gesamtverbands der Aluminiumindustrie
- Aluminium im menschlichen Körper
- Christopher Exley: Aluminium and Medicine. In: Ana Lucia Ramalho Mercê u. a. (Hrsg.): Molecular and Supramolecular Bioinorganic Chemistry. New York 2009, ISBN 978-1-60456-679-6. herbalix.com (PDF; 174 kB; englisch; abgerufen Juni 2013)
- Lars Fischer: Wie gefährlich ist Aluminium? Spektrum.de, 14. Juli 2014.
Einzelnachweise
↑ ab Harry H. Binder: Lexikon der chemischen Elemente. S. Hirzel Verlag, Stuttgart 1999, ISBN 3-7776-0736-3.
↑ Die Werte für die Eigenschaften (Infobox) sind, wenn nicht anders angegeben, aus www.webelements.com (Aluminium) entnommen.
↑ CIAAW, Standard Atomic Weights Revised 2013.
↑ IUPAC, Standard Atomic Weights Revised 2013 (Excel-Tabelle).
↑ Manjeera Mantina, Adam C. Chamberlin, Rosendo Valero, Christopher J. Cramer, Donald G. Truhlar: Consistent van der Waals Radii for the Whole Main Group. In: The Journal of Physical Chemistry A. 113, 2009, S. 5806–5812, doi:10.1021/jp8111556.
↑ David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. CRC Press, 1998, ISBN 0-8493-0479-2.
↑ Aluminium-Taschenbuch – Band 1, 16. Auflage, 2002, Aluminium-Verlag, Düsseldorf, S. 74.
↑ Robert C. Weast (Hrsg.): CRC Handbook of Chemistry and Physics. CRC (Chemical Rubber Publishing Company), Boca Raton 1990, ISBN 0-8493-0470-9, S. E-129 bis E-145. (Werte dort sind auf g/mol bezogen und in cgs-Einheiten angegeben. Der hier angegebene Wert ist der daraus berechnete maßeinheitslose SI-Wert).
↑ ab A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 91.–100., verbesserte und stark erweiterte Auflage. de Gruyter, Berlin 1985, ISBN 3-11-007511-3, S. 868.
↑ ab Yiming Zhang, Julian R. G. Evans, Shoufeng Yang: Corrected Values for Boiling Points and Enthalpies of Vaporization of Elements in Handbooks. In: Journal of Chemical & Engineering Data. 56, 2011, S. 328–337, doi:10.1021/je1011086.
↑ W. B. Frank, W. E. Haupin, H. Vogt, M. Bruno, J. Thonstad, R. K. Dawless, H. Kvande, O. A. Taiwo: Aluminium. In: Ullmann’s Encyclopedia of Industrial Chemistry. Wiley-VCH, Weinheim 2009, doi:10.1002/14356007.a01_459.pub2.
↑ Joseph L. Rose: Ultrasonic Waves in Solid Media. Cambridge University Press, 2004, ISBN 978-0-521-54889-2, S. 44 (eingeschränkte Vorschau in der Google-Buchsuche).
↑ Tribikram Kundu: Ultrasonic and Electromagnetic NDE for Structure and Material Characterization. CRC Press, 2012, ISBN 978-1-4398-3663-7, S. 94 ff. (eingeschränkte Vorschau in der Google-Buchsuche).
↑ Aluminium-Taschenbuch – Band 1, 16. Auflage, 2002, Aluminium-Verlag, Düsseldorf, S. 77.
↑ T. Merkel, K.-H. Thomas: Taschenbuch der Werkstoffe, 7. verbesserte Auflage, 2008, Carl Hanser Verlag, München, S. 294.
↑ Eintrag zu Aluminium, Pulver, nicht stabilisiert in der GESTIS-Stoffdatenbank des IFA, abgerufen am 9. August 2016 (JavaScript erforderlich).
↑ Eintrag zu Aluminium, Pulver, phlegmatisiert in der GESTIS-Stoffdatenbank des IFA, abgerufen am 9. August 2016 (JavaScript erforderlich).
↑ Eintrag zu Aluminium im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. August 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
↑ Datenblatt Aluminium bei AlfaAesar, abgerufen am 13. März 2011 (PDF) (JavaScript erforderlich).
↑ Alumina Production. In: world-aluminium.org. The International Aluminium Institute, abgerufen am 14. Februar 2016.
↑ Primary Aluminium Production. In: world-aluminium.org. The International Aluminium Institute, abgerufen am 14. Februar 2016.
↑ Norman N. Greenwood, Alan Earnshaw: Chemie der Elemente. Wiley-VCH, Weinheim 1988, ISBN 3-527-26169-9.
↑ N. A. Figurowski, Die Entdeckung der chemischen Elemente und der Ursprung ihrer Namen, in deutscher Übersetzung von Leo Korniljew/Ernst Lemke, Moskau 1981, ISBN 3-7614-0561-8, S. 64.
↑ Norman N. Greenwood, Alan Earnshaw: Chemistry of the Elements. 2. Auflage. Butterworth–Heinemann, 1997, ISBN 0-08-037941-9, S. 217.
↑ Mineral Species containing Aluminum (Al) auf Webmineral (englisch).
↑ IMA/CNMNC List of Mineral Names; September 2017 (PDF 1,67 MB; Aluminium siehe S. 7)
↑ IMA/CNMNC List of Mineral Names; 2009 (PDF 1,8 MB, Aluminium siehe S. 7).
↑ Webmineral – Minerals Arranged by the New Dana Classification. 01.01.01 Gold group
↑ B. V. Oleinikov, A. V. Okrugin, N. V. Leskova: Petrological significance of the occurrence of native aluminum in basic rocks. In: Doklady Akademii Nauk SSSR. Band 243, 1978, S. 191–194 (rruff.info [PDF; 239 kB; abgerufen am 11. Januar 2018]).
↑ Michael Fleischer, Adolf Pabst, J. A. Mandarino: New mineral names. In: American Mineralogist. Band 65, 1980, S. 205–210 (rruff.info [PDF; 1,1 MB; abgerufen am 11. Januar 2018]).
↑ Fundortliste für Aluminium beim Mineralienatlas und bei Mindat
↑ Stefan Weiß: Das große Lapis Mineralienverzeichnis. Alle Mineralien von A – Z und ihre Eigenschaften. 6. vollkommen neu bearbeitete und ergänzte Auflage. Weise, München 2014, ISBN 978-3-921656-80-8.
↑ ab Aluminium. In: John W. Anthony, Richard A. Bideaux, Kenneth W. Bladh, Monte C. Nichols (Hrsg.): Handbook of Mineralogy, Mineralogical Society of America. 2001 (handbookofmineralogy.org [PDF; 56 kB; abgerufen am 11. Januar 2018]).
↑ Rudolf Debar: Die Aluminium-Industrie. 2. Auflage. Springer 1925, S. 55 ff. (eingeschränkte Vorschau in der Google-Buchsuche).
↑ Eutektikum Aluminiumoxid/Kryolith. (Memento des Originals vom 19. April 2015 im Internet Archive) Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe den Link gemäß Anleitung und entferne dann diesen Hinweis.@1@2Vorlage:Webachiv/IABot/www.mschaumann.de
Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe den Link gemäß Anleitung und entferne dann diesen Hinweis.@1@2Vorlage:Webachiv/IABot/www.mschaumann.de
↑ Aluminium und Silizium: von der Lagerstätte bis zur Verwendung. (Memento des Originals vom 30. Januar 2012 im Internet Archive) Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe den Link gemäß Anleitung und entferne dann diesen Hinweis.@1@2Vorlage:Webachiv/IABot/www.rz.uni-karlsruhe.de (PDF, Seminararbeit; 527 kB) S. 10.
Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe den Link gemäß Anleitung und entferne dann diesen Hinweis.@1@2Vorlage:Webachiv/IABot/www.rz.uni-karlsruhe.de (PDF, Seminararbeit; 527 kB) S. 10.
↑ ab Matthias Dienhart: Ganzheitliche Bilanzierung der Energiebereitstellung für die Aluminiumherstellung. (PDF; 1,3 MB) Dissertation. Rheinisch-Westfälischen Technischen Hochschule Aachen, Juni 2003, S. 7.
↑ Rainer Quinkertz: Optimierung der Energienutzung bei der Aluminiumherstellung. Dissertation. Rheinisch-Westfälische Technische Hochschule Aachen, 2002, S. 75–77.
↑ World Mine Production, Reserves, and Reserve Base (PDF) In: U.S. Geological Survey. (englisch).
↑ BAUXITE AND ALUMINA. Abgerufen am 3. November 2014 (PDF).
↑ United States Geological Survey: World Smelter Production and Capacity. (PDF-Datei; 87 kB).
↑ R. Feige, G. Merker: SEROX – ein synthetischer Al-Glasrohstoff. (PDF).
↑ Recycling ist nur der zweitbeste Weg. In: Der Spiegel. Nr. 25, 1993 (online).
↑ Udo Boin, Thomas Linsmeyer, Franz Neubacher, Brigitte Winter: Stand der Technik in der Sekundäraluminiumerzeugung im Hinblick auf die IPPC-Richtlinie. (Österreichisches) Umweltbundesamt, Wien 2000, ISBN 3-85457-534-3. (umweltbundesamt.at PDF)
↑ Ralph W. G. Wyckoff: Crystal Structures. 2. Auflage. Band 1. John Wiley & Sons, New York, London, Sydney 1963, S. 3 (im Anhang).
↑ Hugo Strunz, Ernest H. Nickel: Strunz Mineralogical Tables. Chemical-structural Mineral Classification System. 9. Auflage. E. Schweizerbart’sche Verlagsbuchhandlung (Nägele u. Obermiller), Stuttgart 2001, ISBN 3-510-65188-X, S. 35.
↑ Friedrich Ostermann: Anwendungstechnologie Aluminium. 3. Auflage. Springer, 2014, S. 71–78.
↑ abcdefghijklm Friedrich Ostermann: Anwendungstechnologie Aluminium. 3. Auflage. Springer, 2014, S. 212.
↑ Friedrich Ostermann: Anwendungstechnologie Aluminium. 3. Auflage. Springer, 2014, S. 212–213.
↑ ab D. R. Askeland: Materialwissenschaft. Spektrum, Heidelberg 1996, ISBN 3-86025-357-3.
↑ Aluminium-Taschenbuch – Band 1, 16. Auflage, 2002, Aluminium-Verlag, Düsseldorf, S. 79.
↑ Aluminium-Taschenbuch – Band 1, 16. Auflage, 2002, Aluminium-Verlag, Düsseldorf, S. 77.
↑ Wolfgang Weißbach: Werkstoffkunde Strukturen, Eigenschaften, Prüfung. Springer-Verlag, 2012, ISBN 978-3-8348-8318-6, S. 196 (eingeschränkte Vorschau in der Google-Buchsuche).
↑ Bernhard Ilschner: Werkstoffwissenschaften und Fertigungstechnik Eigenschaften, Vorgänge, Technologien. Springer, Berlin 2010, ISBN 978-3-642-01734-6, S. 277.
↑ Friedrich Ostermann: Anwendungstechnologie Aluminium. 3. Auflage. Springer, 2014, S. 214.
↑ Friedrich Ostermann: Anwendungstechnologie Aluminium. 3. Auflage. Springer, 2014, S. 212–214.
↑ Friedrich Ostermann: Anwendungstechnologie Aluminium. 3. Auflage. Springer, 2014, S. 212, 214.
↑ Der Technologie-Leitfaden von ELB. In: Eloxalwerk Ludwigsburg.
↑ Was ist Gefahrgut im Passagiergepäck? (Memento des Originals vom 18. August 2017 im Internet Archive) Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe den Link gemäß Anleitung und entferne dann diesen Hinweis.@1@2Vorlage:Webachiv/IABot/www.lba.de Website des Luftfahrt-Bundesamtes.
Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe den Link gemäß Anleitung und entferne dann diesen Hinweis.@1@2Vorlage:Webachiv/IABot/www.lba.de Website des Luftfahrt-Bundesamtes.
↑ George E. Totten, D. Scott MacKenzie: Handbook of Aluminum Band 1: Physical Metallurgy and Processes. Marcel Dekker, Yew York, Basel. 2003, S. 33–34.
↑ Aluminium-Taschenbuch – Band 1, 16. Auflage, 2002, Aluminium-Verlag, Düsseldorf, S. 98–99, 167–168.
↑ Aluminium-Taschenbuch – Band 1, 16. Auflage, 2002, Aluminium-Verlag, Düsseldorf, S. 189–190.
↑ Aluminium-Taschenbuch – Band 1, 16. Auflage, 2002, Aluminium-Verlag, Düsseldorf, S. 167–168.
↑ Aluminium-Taschenbuch – Band 1, 16. Auflage, 2002, Aluminium-Verlag, Düsseldorf, S. 99.
↑ Aluminium-Taschenbuch – Band 1, 16. Auflage, 2002, Aluminium-Verlag, Düsseldorf, S. 117–118.
↑ Aluminium-Taschenbuch – Band 1, 16. Auflage, 2002, Aluminium-Verlag, Düsseldorf, S. 102–103.
↑ Aluminium-Taschenbuch – Band 1, 16. Auflage, 2002, Aluminium-Verlag, Düsseldorf, S. 152–153.
↑ Aluminium-Taschenbuch – Band 1, 16. Auflage, 2002, Aluminium-Verlag, Düsseldorf, S. 125–126.
↑ Aluminium-Taschenbuch – Band 1, 16. Auflage, 2002, Aluminium-Verlag, Düsseldorf, S. 142–143.
↑ Aluminium-Taschenbuch – Band 1, 16. Auflage, 2002, Aluminium-Verlag, Düsseldorf, S. 153.
↑ Statistiken. Wirtschaftsvereinigung Stahl, abgerufen am 24. Juli 2017.
↑ Preisindex an der London Metall Exchange
↑ D. R. Askeland: Materialwissenschaft. Spektrum, Heidelberg 1996, S. 364.
↑ D. R. Askeland: Materialwissenschaft. Spektrum, Heidelberg 1996, S. 362.
↑ Gesamtverband der Aluminiumindustrie e. V.: Meerwasserbeständigkeit von Aluminiumknetlegierungen. Abgerufen am 29. März 2013 (PDF; 54 kB).
↑ world-aluminium.org: The Global Aluminium Industry 40 years from 1972 (PDF; 308 kB), abgerufen am 17. November 2013.
↑ Absatzmärkte. Gesamtverband der Aluminiumindustrie e.V., abgerufen am 24. Juli 2017.
↑ ab Friedrich Ostermann: Anwendungstechnologie Aluminium. 3. Auflage. Springer, 2014, S. 34–39.
↑ Friedrich Ostermann: Anwendungstechnologie Aluminium. 3. Auflage. Springer, 2014, S. 39–41.
↑ Friedrich Ostermann: Anwendungstechnologie Aluminium. 3. Auflage. Springer, 2014, S. 52–57.
↑
René Flosdorff, Günther Hilgarth: Elektrische Energieverteilung. 8. Auflage. Teubner, 2003, ISBN 3-519-26424-2, Kapitel 1.2.2.4.
↑ Stanley Wolf: Silicon Processing for the VLSI Era. Volume 2: Process Integration. Lattice Press, Sunset Beach, Calif. 1990, ISBN 0-9616721-4-5, S. 191 ff.
↑ Stanley Wolf: Silicon Processing for the VLSI Era. Volume 4: Deep-Submicron Process Technology. Lattice Press, Sunset Beach 2002, ISBN 0-9616721-7-X, S. 723 ff.
↑ vgl. Stanley Wolf: Silicon Processing for the VLSI Era. Volume 4: Deep-Submicron Process Technology. Lattice Press, Sunset Beach 2002, ISBN 0-9616721-7-X, S. 713.
↑ Friedrich Ostermann: Anwendungstechnologie Aluminium. 3. Auflage. Springer, 2014, S. 63 f.
↑ Robert Brockmann: Verlust der Heliumdichtheit. In: Vakuum in Forschung und Praxis. Band 26, Nr. 2, 1. April 2014, S. 19–22, doi:10.1002/vipr.201400547 (PDF).
↑ Verheilung von Aluminium: Aktuelles zum UST-Verfahren.
↑ Friedrich Ostermann: Anwendungstechnologie Aluminium. 3. Auflage. Springer, 2014, S. 65.
↑ https://www.spotlightmetal.com/how-environmentally-friendly-is-the-european-aluminium-industry-gal-691065/?p=3
↑ Joachim Achtziger, Günter Pfeifer, Rolf Ramcke, Konrad Zilch: Mauerwerk Atlas. Institut für internationale Architektur-Dokumentation, 2001, S. 59 (eingeschränkte Vorschau in der Google-Buchsuche).
↑ K. Zilch, C. J. Diederichs, R. Katzenbach, K. J. Beckmann (Hrsg.): Handbuch für Bauingenieure. Technik, Organisation und Wirtschaftlichkeit. 2. Auflage. Springer, 2012, ISBN 978-3-642-14449-3, S. 182.
↑ Friedrich Ostermann: Anwendungstechnologie Aluminium. 3. Auflage. Springer, 2014, S. 57–59.
↑ Alcoa Architectural Products (Hrsg.): Aluminium-Verbundplatten und -bleche: Umformen, Gestalten, Begeistern. 30. September 2013 (arconic.com [PDF; 720 kB; abgerufen am 21. Juni 2017] Faltblatt).
↑ Wolfgang Hoferer: Butzen aus Aluminium. Hrsg.: Aluminium-Werke Wutöschingen (= EG-Sicherheitsdatenblatt gemäß 91/155/EWG. EG-Richtlinie .9.99). 5. Mai 2008, Blatt 4 (aww.de [PDF; 33 kB; abgerufen am 21. Juni 2017] Erste Version 29. März 2007).
↑ Bernd Leitenberger: Chemische Raketentreibstoffe Teil 1. In: Bernd Leitenbergers Web Site.
↑ Aluminium auf Feuerwerk-Wiki: www.feuerwerk.net.
↑ Eberhard Roos, Karl Maile: Werkstoffkunde für Ingenieure, 4. bearbeitete Auflage, 2011, Springer, S. 252.
↑ A. Herbert Fritz, Günter Schulze: Fertigungstechnik. 10. Auflage. Springer, Berlin 2012, ISBN 978-3-642-29785-4, S. 36.
↑ Rüdiger Bähr: Urformen in: Molitor, Grote, Herold, Karpuschewski: Einführung in die Fertigungslehre, Shaker, 2008, S. 19.
↑ Heiko Lickfett: Wirtschaftliche Bedeutung der Gießereiindustrie in: Andreas Bühring-Polaczek, Walter Michaeli, Günter Spur (Hrsg.): Handbuch Urformen, Hanser, 2014, S. 13–16.
↑ Bernhard Ilschner, Robert F. Singer: Werkstoffwissenschaften und Fertigungstechnik: Eigenschaften, Vorgänge, Technologien. 5. Auflage. Springer, Berlin 2010, S. 449–450.
↑ Friedrich Ostermann: Anwendungstechnologie Aluminium. 3. Auflage. Springer, 2014, S. 419–422.
↑ Wolfgang Lehnert: Umformung von Aluminium-Werkstoff. In: Günter Drossel, Susanne Friedrich, Catrin Kammer, Wolfgang Lehnert (Hrsg.): Aluminium Taschenbuch: Band 2: Umformung von Aluminium-Werkstoffen, Gießen von Aluminium-Teilen, Oberflächenbehandlung von Aluminium, Recycling und Ökologie. 16. Auflage. Beuth, Berlin 2009, ISBN 978-3-410-22029-9, S. 1 (Leseprobe (PDF) [abgerufen am 14. September 2014]).
↑ Fritz Klocke, Wilfried König: Fertigungsverfahren 4: Umformen. 5. Auflage. Springer, Heidelberg, S. 89–90.
↑ Friedrich Ostermann: Anwendungstechnologie Aluminium. 3. Auflage. Springer, 2014, S. 441–450.
↑ Friedrich Ostermann: Anwendungstechnologie Aluminium. 3. Auflage. Springer, 2014, S. 451–462.
↑ Eberhard Roos, Karl Maile: Werkstoffkunde für Ingenieure: Grundlagen, Anwendung, Prüfung. 4. Auflage. Springer, Berlin 2011, S. 240.
↑ Wilfried König, Fritz Klocke: Fertigungsverfahren 1: Drehen, Bohren, Fräsen. 8. Auflage. Springer 2008, ISBN 978-3-540-23458-6, S. 319.
↑ Thorsten Zurell: Absaugung von Aluminium-Schleifstäuben und -Schweißrauchen im Automobilbau mit ex-geschützten Filtersystemen. In: Gefahrstoffe – Reinhalt. Luft. 62, Nr. 11/12, 2002, S. 455–460.
↑ Hans J. Fahrenwaldt: Praxiswissen Schweißtechnik: Werkstoffe, Prozesse, Fertigung. 3. Auflage. Vieweg+Teubner, Wiesbaden 2008, ISBN 978-3-8348-0382-5, S. 205.
↑ Hans J. Fahrenwaldt: Praxiswissen Schweißtechnik: Werkstoffe, Prozesse, Fertigung. 3. Auflage. Vieweg+Teubner, Wiesbaden 2008, ISBN 978-3-8348-0382-5, S. 71, 206.
↑ Udo M. Spornitz: Anatomie und Physiologie. Lehrbuch und Atlas für Pflege- und Gesundheitsfachberufe. Springer, Berlin 2010, ISBN 978-3-642-12643-7.
↑ ab Eintrag zu Aluminium. In: Römpp Online. Georg Thieme Verlag, abgerufen am 12. Juni 2013.
↑ abcd ALUMINIUM IN IMPFSTOFFEN. (arznei-telegramm.de [abgerufen am 6. Oktober 2018]).
↑ abc Waldemar Ternes: Biochemie der Elemente: Anorganische Chemie biologischer Prozesse. Springer DE, 2013, ISBN 978-3-8274-3019-9 (eingeschränkte Vorschau in der Google-Buchsuche).
↑ Wilfried Puwein: Das „Waldsterben“ in Österreich und seine ökonomischen Folgen. Nr. 11, 1989 (wifo.ac.at PDF; 792 kB).
↑ Hideaki Matsumoto: Cell biology of aluminum toxicity and tolerance in higher plants. In: International Review of Cytology. Band 200, 2000, S. 1–46, doi:10.1016/S0074-7696(00)00001-2.
↑ Bunichi Ezaki u. a.: Different mechanisms of four aluminum (Al)-resistant transgenes for Al toxicity in Arabidopsis. In: Plant Physiology. Band 127, Nr. 3, 2001, S. 918–927, PMID 11706174.
↑ Charlotte Poschenrieder u. a.: A glance into aluminum toxicity and resistance in plants. In: Science of the Total Environment. Band 400, Nr. 1–3, 2008, S. 356–368, doi:10.1016/j.scitotenv.2008.06.003.
↑ Sanjib Kumar Panda, Frantisek Baluska, Hideaki Matsumoto: Aluminum stress signaling in plants. In: Plant Signaling & Behaviour. Band 4, Nr. 7, 2009, S. 592–597, PMID 19820334, PMC 2710549 (freier Volltext).
↑ Norwegens Süßwasserfische sterben am sauren Regen. In: Arbeiter-Zeitung. Wien 29. September 1981, S. 10, unten links (arbeiter-zeitung.at – das offene Online-Archiv – Digitalisat).
↑ Bundesverband der Lebensmittelchemiker/-innen im öffentlichen Dienst e.V. (BLC): Aluminium in Lebensmitteln.
↑ abc Scientific Opinion of the Panel on Food Additives, Flavourings, Processing Aids and Food Contact. Materials on a request from European Commission on Safety of aluminium from dietary intake. In: The EFSA Journal. 754, 2008, S. 1–34 (PDF-Datei; 550 kB).
↑ Aluminium in Lebensmitteln: lebensmittel.org.
↑ abc Bundesinstitut für Risikobewertung (Hrsg.): Keine Alzheimer-Gefahr durch Aluminium aus Bedarfsgegenständen. (PDF; 106 kB) 22. Juli 2007.
↑ Efsa-Beratung zur Sicherheit von Aluminium in Lebensmitteln auf efsa.europa.eu
↑ Aluminium in der Datenbank für Lebensmittelzusatzstoffe.
↑ Chemisches und Veterinäruntersuchungsamt Karlsruhe: Laugengebäck: Wie gelangt Aluminium in das Gebäck? (PDF) 2004.
↑ H. Eschnauer: Die Verwendung von Aluminium in der Weinwirtschaft. Vitis, 1, 1958, S. 313–320, zitiert von S. 319, vitis-vea.de (PDF; 729 kB).
↑ H. E. Müller, W. Dünnleder, W. Mühlenberg, R. Ruckdeschel: Legionellen – ein aktives Problem der Sanitärhygiene. 3. Auflage. expert-Verlag, ISBN 978-3-8169-2725-9, S. 14 (eingeschränkte Vorschau in der Google-Buchsuche).
↑ H. J. Gitelman: Physiology of Aluminum in Man. In: Aluminum and Health. CRC Press, 1988, ISBN 0-8247-8026-4, S. 90 (eingeschränkte Vorschau in der Google-Buchsuche).
↑ ab P. C. Ferreira, A. Piai, A. M. Takayanagui, S. I. Segura-Muñoz: Aluminum as a risk factor for Alzheimer’s disease. In: Revista Latino-Americana de Enfermagem. Band 16, Nr. 1, 2008, S. 151–157, doi:10.1590/S0104-11692008000100023, PMID 18392545.
↑ Jakob Kneser: Mr. Aluminium. Lücken in der Aluminium-Forschung. WDR, 17. Oktober 2017, abgerufen am 21. Dezember 2017.
↑ Bundesinstitut für Risikobewertung (Hrsg.): Aluminiumhaltige Antitranspirantien tragen zur Aufnahme von Aluminium bei. (PDF; 144 kB) 26. Februar 2014.
↑ Aluminium and Alzheimer’s disease. (Memento des Originals vom 11. März 2012 im Internet Archive) Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe den Link gemäß Anleitung und entferne dann diesen Hinweis.@1@2Vorlage:Webachiv/IABot/alzheimers.org.uk The Alzheimer’s Society. Abgerufen am 30. Januar 2009.
Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe den Link gemäß Anleitung und entferne dann diesen Hinweis.@1@2Vorlage:Webachiv/IABot/alzheimers.org.uk The Alzheimer’s Society. Abgerufen am 30. Januar 2009.
↑ V. Rondeau, H. Jacqmin-Gadda, D. Commenges, C. Helmer, J.-F. Dartigues: Aluminum and Silica in Drinking Water and the Risk of Alzheimer’s Disease or Cognitive Decline: Findings From 15-Year Follow-up of the PAQUID Cohort. In: American Journal of Epidemiology. Band 169, Nr. 4, 2008, S. 489–496, doi:10.1093/aje/kwn348, PMID 19064650, PMC 2809081 (freier Volltext).
↑ Sakae Yumoto, Shigeo Kakimi, Akihiro Ohsaki, Akira Ishikawa: Demonstration of aluminum in amyloid fibers in the cores of senile plaques in the brains of patients with Alzheimer’s disease. In: Journal of Inorganic Biochemistry. Band 103, Nr. 11, 2009, S. 1579–1584, doi:10.1016/j.jinorgbio.2009.07.023, PMID 19744735.
↑ H. Lüllmann, K. Mohr, M. Wehling, L. Hein: Pharmakologie und Toxikologie, Thieme Verlag, 2016, ISBN 978-3-13-368518-4, S. 622–623.
↑ Aluminium-Industrie (Memento vom 2. Mai 2010 im Internet Archive) auf staufenbiel.de
↑ Steel in the circular economy – A life cycle perspective. (Memento des Originals vom 12. April 2016 im Internet Archive) Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe den Link gemäß Anleitung und entferne dann diesen Hinweis.@1@2Vorlage:Webachiv/IABot/www.worldsteel.org (PDF) S. 16.
Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe den Link gemäß Anleitung und entferne dann diesen Hinweis.@1@2Vorlage:Webachiv/IABot/www.worldsteel.org (PDF) S. 16.
↑ Hans Daxbeck, Adolf Merl, Eva Ritter, Paul H. Brunner: Analyse der Flüsse des lizenzierten Aluminiums in Österreich. Technische Universität Wien, Institut für Wassergüte und Abfallwirtschaft, 2000 (rma.at PDF).
↑ International Aluminium Journal. Nr. 6, 2013, S. 81 ff.
↑ International Aluminium Journal. Nr. 91, 2015, S. 53.
↑ Uwe Kerkow, Jens Martens, Axel Müller: Vom Erz zum Auto. (Memento des Originals vom 10. Oktober 2015 im Internet Archive) Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe den Link gemäß Anleitung und entferne dann diesen Hinweis.@1@2Vorlage:Webachiv/IABot/www.misereor.de (PDF) Aachen/ Bonn/ Stuttgart 2012, ISBN 978-3-943126-07-5, S. 29.
Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe den Link gemäß Anleitung und entferne dann diesen Hinweis.@1@2Vorlage:Webachiv/IABot/www.misereor.de (PDF) Aachen/ Bonn/ Stuttgart 2012, ISBN 978-3-943126-07-5, S. 29.
↑ Manfred Sietz, Stefan Seuring: Ökobilanzierung in der betrieblichen Praxis. Eberhard Blottner, Taunusstein 1997, S. 103 (eingeschränkte Vorschau in der Google-Buchsuche).
↑ Case history: The truth about recycling. In: The Economist. 2007.
↑ J. Strähle, E. Schweda: Jander · Blasius – Lehrbuch der analytischen und präparativen anorganischen Chemie, 16. Auflage, Hirzel, Stuttgart 2006, ISBN 3-7776-1388-6, S. 626.
.mw-parser-output div.NavFrame{border:1px solid #A2A9B1;clear:both;font-size:95%;margin-top:1.5em;min-height:0;padding:2px;text-align:center}.mw-parser-output div.NavPic{float:left;padding:2px}.mw-parser-output div.NavHead{background-color:#EAECF0;font-weight:bold}.mw-parser-output div.NavFrame:after{clear:both;content:"";display:block}.mw-parser-output div.NavFrame+div.NavFrame,.mw-parser-output div.NavFrame+link+div.NavFrame{margin-top:-1px}.mw-parser-output .NavToggle{float:right;font-size:x-small}


+2 OH^{-}(aq)}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/a732a2263125aca5df8ea80c46a7974bb87472cc)
+3 e^{-}+2 H_{3}O^{+}(aq)}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/6524b2768718ef36682d719c25015626f764b083)










