Methadon
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
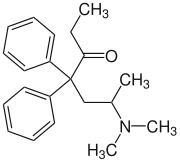 | ||||||||||||||||
| Struktur ohne Stereochemie | ||||||||||||||||
| Allgemeines | ||||||||||||||||
Freiname | Methadon | |||||||||||||||
| Andere Namen |
| |||||||||||||||
Summenformel | C21H27NO | |||||||||||||||
| Kurzbeschreibung | Weißes bis fast weißes, kristallines Pulver (L-Polamidon·Hydrochlorid)[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||
ATC-Code | N07BC02 N02AC52 | |||||||||||||||
Wirkstoffklasse |
| |||||||||||||||
| Eigenschaften | ||||||||||||||||
Molare Masse | 309,45 g·mol−1(Methadon) | |||||||||||||||
Schmelzpunkt |
| |||||||||||||||
pKs-Wert | 8,94[3] | |||||||||||||||
Löslichkeit |
| |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
Toxikologische Daten |
| |||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Methadon ist ein vollsynthetisch hergestelltes Opioid mit starker schmerzstillender Wirksamkeit. Methadon ist reiner Agonist am μ-Opioid-Rezeptor. Es hat als Heroin-Ersatzstoff im Rahmen von Substitutionsprogrammen seine Wirksamkeit bewiesen[5] und wurde deshalb 2005 von der Weltgesundheitsorganisation (WHO) in die Liste der unentbehrlichen Arzneimittel der Weltgesundheitsorganisation aufgenommen.[6]
Inhaltsverzeichnis
1 Geschichte
2 Chemie
2.1 Gewinnung und Darstellung
2.2 Stereochemie
3 Pharmakologie
4 Wirkung
4.1 Untersuchte Wirkung in der Krebstherapie
5 Nebenwirkungen
5.1 QT-Zeit-Verlängerung
5.2 Intoxikation
6 Anwendung
7 Handelsnamen
8 Siehe auch
9 Literatur
10 Weblinks
11 Einzelnachweise
Geschichte |
Die später Methadon benannte Substanz wurde 1937[7] von Max Bockmühl und Gustav Ehrhart, zwei Mitarbeitern der zum I.G. Farben-Konzern gehörenden Hoechster Farbwerke, mit der Synthesenummer VA 10820 entwickelt und 1938 zum Patent angemeldet.[8][9] Die analgetische Wirkung von VA 10820 wurde 1942 in einer kleinen klinischen Studie erstmals festgestellt. Erst 1945 wurde diese Wirkung von Otto Schaumann, beziehungsweise unabhängig von ihm von Charles C. Scott und K. K. Chen,[10] beides Mitarbeiter an den Lilly Research Laboratories. von Eli Lilly, definitiv nachgewiesen. Nach dem Zweiten Weltkrieg kam VA 10820 auf dem Weg der Patent- und Vorschriftenenteignung in die Vereinigten Staaten. 1947 erhielt VA 10820 den Freinamen Methadon bzw. in den USA Methadone. Im gleichen Jahr erfolgte von Eli Lilly die Markteinführung eines racemischen Methadons unter dem Markennamen Dolophine®. Jede ausländische Firma konnte das Herstellungsrecht erwerben. Später wurde Methadon dann weltweit unter verschiedenen Markennamen vertrieben. Im Januar 1949 konnte die nach der Auflösung der I.G. Farben neu gegründete Hoechst AG Methadon monochiral unter der Bezeichnung Polamidon® (Levomethadon) als stark wirkendes Schmerzmittel selbst auf den Markt bringen.[11]
Seit den 1960er Jahren wird Methadon (zuerst in den USA) als Substitutionsmittel bei Heroinabhängigkeit eingesetzt, wobei in den ersten Jahren ausschließlich mit sehr hohen Dosen in hochstrukturierten Programmen mit dem Ziel einer Dauersubstitution gearbeitet wurde – dies, weil die Opioidabhängigkeit als metabolische Störung gesehen wurde, die wie andere Stoffwechselerkrankungen auch zu behandeln sei.[12] In Deutschland wurde die Substitutionsmethode mit Dihydrocodein von dem Kieler Arzt Gorm Grimm eingeführt.[13]
Chemie |
Gewinnung und Darstellung |
Methadon wird vollsynthetisch hergestellt, im Gegensatz z. B. zu Heroin, das halbsynthetisch aus dem natürlichen Opium-Alkaloid Morphin hergestellt wird. Chemisch-strukturell unterscheidet sich Methadon deutlich von Morphin und Heroin. Die technische Synthese des racemischen Methadons ist recht einfach und geht aus von dem durch Kolbe-Nitrilsynthese leicht erhältlichen Diphenylacetonitril hervor.[14]

Stereochemie |
Methadon ist chiral, es liegt daher in der Regel als 1:1-Gemisch (Racemat) von zwei spiegelbildlichen Molekülen (Enantiomeren) vor. Im Gegensatz zum linksdrehenden Levomethadon ist das rechtsdrehende Dextromethadon zwar ein potentes Antitussivum, besitzt aber nahezu keine analgetische Potenz. Daraus ergibt sich, dass L-Polamidon® (Levomethadon) doppelt so stark analgetisch wirksam ist wie das rac-Methadon, und L-Polamidon demnach gegenüber rac-Methadon nur halb so hoch zu dosieren ist. In Deutschland sind rac-Methadon (Methaddict®-Tabletten bzw. als Grundsubstanz) und Levomethadon zur Heroinsubstitution oder als starkes Schmerzmittel verschreibungsfähig und über Apotheken beziehbar.
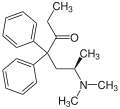
Levomethadon oder L-Methadon
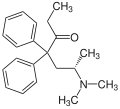
Dextromethadon oder D-Methadon
Eine Trennung des racemischen Gemischs kann über diastereomere Salze mit L-(+)-Weinsäure erfolgen.[15]
Die reinen Enantiomere der freien Base schmelzen bei 100 °C. Das Racemat liegt als racemisches Gemisch mit einem eutektischen Schmelzpunkt von 77 °C vor. Enantiomerenreines Methadon-Hydrochlorid zeigt einen Schmelzpunkt bei 248 °C. Im Falle des 1:1-Gemisches der enantiomeren Hydrochloride wird eine racemische Verbindung mit einem Schmelzpunkt von 237 °C gebildet, die im Phasendiagramm eutektische Schmelzpunkte mit den Enatiomeren bei 233 °C bei Zusammensetzungen von 0.29/0,71 bzw. 0,71/0,29 zeigen.[2]

Phasendiagramm von Methadon Base

Phasendiagramm von Methadon-Hydrochlorid mit R - racemische Verbindung, E - Eutektikum
Pharmakologie |
Methadon bindet wie viele Opiate an Opioidrezeptoren und entfaltet dort seine schmerzstillende Wirkung. Darüber hinaus bindet es dosisabhängig an den HERG-Kanal, einen spannungsaktivierten, einwärtsgleichrichtenden Kaliumkanal in Herzmuskelzellen, und blockiert diesen in der Folge, wodurch es zu einer QT-Zeit-Verlängerung kommt (siehe Long-QT-Syndrom). Methadon wird hauptsächlich über das Isoenzym CYP3A4 zu den inaktiven Metaboliten 2-Ethyliden-1,5-dimethyl-3,3-diphenylpyrrolidin (EDDP) und 2-Ethyl-5-methyl-3,3-diphenylpyralin (EMDP) abgebaut.[16] In geringerem Ausmaß spielen 2B6, 2C8, 2C18, 2C19 und 2D6 eine Rolle.[17][18] Die gleichzeitige Einnahme von Medikamenten, die diesen Abbauweg blockieren, führt zu einer Erhöhung der Plasmakonzentration von Methadon, ebenso wie die Einnahme von Medikamenten, die stark an Plasmaproteine gebunden werden, da Methadon zu 85–90 % an ebendiese Proteine gebunden wird.
Umgekehrt kann Kokain die Plasmakonzentration von Methadon verringern.[19] Tabellarische Auflistungen der Interaktionen von Methadon mit anderen Medikamenten stehen zur Verfügung.[20]
Wirkung |
Methadon hat als Opioid dasselbe Wirkungs- und Nebenwirkungsprofil und somit im Wesentlichen dasselbe Gefahrenpotential wie andere Opioide (Ausnahme: Buprenorphin). Allerdings erzeugt es wegen der langsamen Anflutung bei oraler Anwendung keinen Kick (jenes plötzliche intensive Wohlbefinden, das mit zur Entstehung einer Sucht führt).
Eingesetzt wird Methadon vor allem in unterschiedlichsten Abgabeprogrammen für Heroinabhängige. Diesbezüglich gilt eine Methadongabe als eine der wirksamsten Therapien überhaupt, sodass Vergleichsstudien gegenüber Placebo seit Anfang der 1980er Jahre aus ethischen Gründen nicht mehr vertretbar sind. Allerdings muss auch betont werden, dass ein Großteil der beabsichtigten Methadonwirkung auf der Tatsache beruht, dass es in besonderen, strukturierten Programmen angeboten wird.[12] Bei den meisten Teilnehmern führt eine tägliche Einmalgabe zur gewünschten Stabilisierung, wobei durch eine Cochrane-Studie zumindest zweifelsfrei belegt werden konnte, dass durch Methadon Patienten in Betreuung gehalten werden können und es zu weniger Heroin-Konsum kommt.[5] Zu beachten ist hier, dass (vom Patienten selbst als ausreichend bezeichnete) Dosierungen bis zu 40 mg durch handelsübliches Straßenheroin leicht „überwunden“ werden. Eine Opioidblockade-Wirkung kann erst ab Dosierungen von 60 mg erzielt werden: Das heißt, dass ein Beikonsum von handelsüblichen Opioiden wie Morphin, Heroin oder Hydromorphon keine narkotischen (und euphorisierenden) Effekte bewirkt.[21]
Einige Substituierte bauen Methadon schneller ab (sogenannte „fast metabolizer“), sodass es zum Ende eines 24-stündigen Dosierungsintervalls zu Entzugssymptomen kommen kann, und hier u. U. eine Abgabe in zwei Tagesdosen erfolgen muss.[12] Ist eine Abstinenz von Opioiden das Behandlungsziel, können bei langsamem Ausschleichen die Entzugssymptome erträglich gehalten werden. Auch der Heroinentzug selbst kann mit Methadon aufgefangen und zu Ende geführt werden (z. B. bei Krankenhaus- und Gefängnisaufenthalten). Ein langsames Ausschleichen von Methadon kann sich über mehrere Monate hinziehen und ab einer bestimmten Restmenge kann es zu unangenehmen Entzugserscheinungen kommen.
Untersuchte Wirkung in der Krebstherapie |
Eine mögliche verstärkende Wirkung Methadons auf Zytostatika (wie beispielsweise Doxorubicin) in der Krebstherapie ist Gegenstand erster klinischer Prüfungen. Aus In-vitro-Studien[22][23] wurde postuliert, dass Methadon in verschiedenen soliden Tumoren und bei Leukämie einen Zelltod verursachen könne. Hierbei soll eine vermutlich durch Methadon induzierte Aktivierung des Opioidrezeptors zu einer Herunterregulierung von cAMP führen, wodurch das Tumorwachstum stoppe. Darüber hinaus soll Methadon den intrazellulären Calcium-Stoffwechsel stören, was eine morphologische und funktionelle Änderung der Mitochondrien verursacht.
In einer retrospektiven Studie wurden aus einem Kollektiv von 938 Patienten mit Krebserkrankungen 76 identifiziert, die wegen Schmerzen von einem anderen Opioid auf Methadon umgestellt worden waren. Diese wurden mit 88 Patienten verglichen, die in ähnlicher Situation auf ein anderes Opioid umgestellt worden waren. In Hinblick auf das Gesamtüberleben zeigten sich keine Unterschiede.[24] Daten einer anderen Studie mit 52 Krebspatienten (Kopf-Halstumoren) ergaben ebenfalls keinen Hinweis auf einen Vorteil von Methadon hinsichtlich des Überlebens im Vergleich zu einem anderen Opioid (hier Fentanyl).[25]
Methadon wird in der Krebstherapie auch als klassisches Schmerzmittel angewandt, Anwendungsstudien haben bisher keinen antitumoralen Effekt bei Methadon (oder anderen Opioiden) belegt.[26][27] Die Deutsche Gesellschaft für Hämatologie und Medizinische Onkologie sowie die Deutsche Gesellschaft für Neurologie[28] zweifeln an der Wirksamkeit von Methadon in der Krebstherapie und warnen vor unrealistischen Erwartungen[29], die möglicherweise nach Veröffentlichung einer einzigen, unkontrollierten Studie von 2017 (mit 27 Krebspatienten mit Glioblastomen unterschiedlicher Stadien)[30] aufgekommen sein könnten.[31] Der Sprecher im Vorstand der Neuroonkologischen Arbeitsgemeinschaft (NOA), Wolfgang Wick, hält die Datenbasis als Ansatz für eine mögliche Therapie für unzureichend.[32] Auch die Universität von Ulm, an dessen Institut für Rechtsmedizin die ersten wissenschaftlichen Erkenntnisse gewonnen wurde, distanziert sich ausdrücklich und hält den unkritischen Einsatz von Methadon außerhalb klinischer Studien für nicht gerechtfertigt.[33]
2017 verfasste das Ärztliche Zentrum für Qualität in der Medizin im Auftrag der Kassenärztlichen Bundesvereinigung und der Bundesärztekammer eine Patienteninformation zum Thema Methadon in der Krebstherapie.[34] Ebenfalls 2017 wurde die Finanzierung einer Studie bei der Deutschen Krebshilfe beantragt, um die Wirkung in der Krebstherapie zu überprüfen.[35] Für 2022 rechnet man mit Ergebnissen.[32] Bei Zellkulturexperimenten hat man dagegen bereits gezeigt, dass weder R-(−)-Methadon (Levomethadon) alleine noch in Kombination mit dem Chemotherapie-Medikament Temozolomid bei Glioblastomen wirksam ist.[36][37] Möglicher Grund für die fehlende Wirksamkeit ist das Fehlen von spezifischen Andockstellen, so dass Methadon keine Anti-Tumor-Wirkung bei den untersuchten Glioblastom-Zellkulturen entfalten könne.
Nebenwirkungen |
Eine Beurteilung der unerwünschten Wirkungen des Methadons ist von mehreren Voraussetzungen abhängig. Erstens kann ein Mensch mit einer seit mehreren Jahren bestehenden Opiatabhängigkeit bezüglich Wirkung und Nebenwirkungen eines Opiatersatzstoffes schwerlich einem Menschen ohne Drogenerfahrung gegenübergestellt werden. Zweitens können angegebene Nebenwirkungen des Medikaments als Symptome von Erkrankungen aufgefasst werden, die schon zur Zeit des Drogenkonsums bestanden oder durch den Drogenkonsum entstanden und zu diesem Zeitpunkt nicht entsprechend wahrgenommen oder berücksichtigt wurden. Drittens sind auch Besonderheiten der Drogenkultur mit ihren bestimmten Sichtweisen in Rechnung zu stellen.[38][39]
Tatsächlich dürfte es so sein, dass viele unerwünschte Wirkungen als Folge einer zu Beginn der Substitutionsbehandlung ungeeigneten Medikamentendosis zu erklären sind.
So ist auch die gesuchte Euphorie aufgrund der Toleranzentwicklung trotz höherer Heroindosen zunehmend schwer zu erzielen. Dass Substituierte mit hohen Dosen an Methadon unter ausreichend langer Behandlung kaum mehr über unerwünschte Wirkungen – wie Schläfrigkeit und Benommenheit – klagen als Substituierte mit niedrigen Methadondosen (3,9 % gegenüber 4,3 %),[40] dürfte auf ebendiese Toleranzentwicklung zurückzuführen sein.
Nebenwirkungen können bei Methadondosen auftreten, die die vorbestehende Toleranz gegenüber Opioiden aufgrund des Vorkonsums überschreiten. Dies sind Müdigkeit, Schlafstörungen, Benommenheit, Übelkeit, Erbrechen, Ödeme (Flüssigkeitseinlagerung) in den Beinen, Harnverhaltung und Obstipation (Verstopfung). Sie verschwinden in der Regel mit der Toleranzentwicklung oder Reduktion der Dosis. Am längsten halten sich Schlaf- und sexuelle Störungen (bei einer Substitutionsdauer von drei Jahren noch in ca. 20 Prozent). Bis zu 50 Prozent der Substituierten klagen teilweise noch länger über verstärktes Schwitzen (Hyperhidrose).[21]
Anwendung während Schwangerschaft und Stillzeit: Die Methaddict-Tabletten haben bei Einnahme während der Schwangerschaft eine Wirkung auf den Fötus. Deswegen wird empfohlen die Substitution mit Methadon vor der Geburt ausschleichend zu beenden. Wenn das Ausschleichen nicht möglich ist, muss der Entzug des Neugeborenen auf einer Kinderintensivstation durchgeführt werden. Es wurden Augenanomalien, neurologische Befunde mit Hörstörungen, geistigen und motorischen Entwicklungsverzögerungen und eine erhöhte Inzidenz von Otitis media beobachtet. Da Methadon über die Muttermilch ausgeschieden wird, muss im Einzelfall ein Arzt entscheiden, ob die Mutter ihr Kind stillen darf.[41]
QT-Zeit-Verlängerung |
Eine Verlängerung der QT-Zeit im EKG stellt einen Risikofaktor für das Auftreten von Herzrhythmusstörungen und hier besonders von potentiell lebensgefährlichen Torsade de pointes (TdP) dar. Eine Reihe von Faktoren wurde identifiziert, die die Wahrscheinlichkeit einer QT-Zeit-Verlängerung und nachfolgenden TdP erhöhen, nämlich weibliches Geschlecht, Hypokaliämie, erniedrigte Magnesium-Serumspiegel, bekannte Arzneimittelinteraktionen in der Vorgeschichte, bestehende Herzprobleme, ein unerkanntes angeborenes Long-QT-Syndrom (LQTS) und ein prädisponierender DNA-Polymorphismus. Zur Bedeutung dieser Faktoren für Methadonsubstituierte können bislang allerdings noch keine Angaben gemacht werden. Trotzdem müssen sie in der Substitutionstherapie berücksichtigt werden.[42] Etwa 2 % der Patienten, die Methadon erhalten, entwickeln eine verlängerte QT-Zeit, von diesen wieder rund 2 % Torsade de pointes. 2009 wurden in den USA Leitlinien für das QT-Zeit-Screening bei Methadonsubstitution veröffentlicht.[43] Verlängerungen der QT-Zeit und Torsade-de-pointes-Episoden waren ursprünglich auch der Grund für das Aussetzen der Vermarktung von LAAM.
Die QT-Zeit-Verlängerung wird hauptsächlich über Dextromethadon vermittelt, eine QT-Zeit-Verlängerung tritt daher auch nur bei der Substitution mit dem Racemat auf. Eine durch das Racemat induzierte QT-Zeit-Verlängerung kann durch einen Wechsel der Substitution auf Levomethadon (L-Polamidon) rückgängig gemacht werden.[44] Für Dosen unter 100 mg pro Tag sind keine klinisch relevanten Veränderungen der QT-Zeit nachweisbar.[45]
Eine Methadongabe gilt als sicher, solange die Möglichkeit einer QT-Zeit-Verlängerung berücksichtigt, mittels EKG-Kontrollen vor der Therapie, einen Monat nach Therapiebeginn und dann in jährlichen Abständen überprüft wird, die Patienten informiert und entsprechende Konsequenzen aus den Ergebnissen gezogen werden. Somit empfehlen diese Richtlinien auch keinen Wechsel auf ein anderes Substitutionsmittel,[46][47] nachdem in den USA retardierte Morphine, die keine QT-Zeit-Veränderung bewirken, in Substitutionsprogrammen nicht zugelassen sind. In Österreich ist ein Wechsel auf ebendiese retardierten Morphine möglich.
Intoxikation |
Zeichen einer Überdosierung von Opioiden sind bis zur Größe eines Stecknadelkopfes verengte Pupillen (Miosis), schwere Atemdepression und Bewusstseinsstörungen bis zum Koma (als sog. Opioidtrias), Blutdruckabfall mit Tachykardie, Hypothermie und abgeschwächte Reflexe bis zur Areflexie.[48] Bei Personen ohne Opioid-Toleranz können weniger als ein Milligramm pro Kilogramm Körpergewicht tödlich sein. Das heißt, dass die tödliche Dosis für ein Kleinkind weniger als 10 mg und für Erwachsene 40–50 mg betragen kann.[12] Bei einer Einstellung auf Methadon waren Todesfälle in den ersten zwei Wochen der Behandlung mit einem Dosisbereich von 25–100 mg verbunden, wobei die meisten bei Dosierungen von 40–60 mg auftraten. Wenn immer möglich sollten daher Patienten zur Zeit des ersten Wirkungsmaximums (drei bis vier Stunden nach der ersten Einnahme) auf Zeichen der Überdosierung (oder anhaltende Entzugssymptome) überprüft werden.[17] Zur Behandlung einer Überdosierung stehen antagonistisch wirkende Medikamente wie z. B. Naloxon oder Naltrexon zur Verfügung, wobei die Wirkdauer von ersterem wesentlich kürzer ist (ca. 1 Stunde) als die des Wirkstoffs Methadon bzw. Levomethadon (bis 48 Stunden atemdepressive Wirkung) und deshalb ggf. mehrfach nachdosiert werden muss.
Opioidabhängige mit regelmäßigem Konsum sind für eine Intoxikation weniger empfänglich als Gelegenheitskonsumenten oder Abhängige nach einem Opioidentzug.[48]
Anwendung |
Methadon ist in Tropfen- oder Tablettenform, in Österreich ausschließlich als Sirup, erhältlich. Es besitzt eine vergleichsweise hohe orale Bioverfügbarkeit von etwa 80 %.[49] Für die Einnahme wird es meist mit Zuckersirup, Saft oder Wasser verdünnt oder eingefärbt, um so bei einer Take-Home-Vergabe den missbräuchlichen intravenösen Konsum zu verhindern.[50][51] In Deutschland hat sich hauptsächlich die Verabreichung vor Ort von flüssigen Zubereitungen durchgesetzt.[50] Dies bietet den Vorteil, bei einer Abdosierung die Dosis langsam in sehr kleinen (bis hin zu tropfenweisen) Schritten verringern zu können, was Entzugserscheinungen zu vermeiden hilft. Überdies wird so vermieden, dass die Patienten ungeschluckte Tabletten anschließend wieder ausspucken, um sich diese später zu injizieren oder veräußern, wie es bei Subutex (Wirkstoff: Buprenorphin) oft geschieht. Methadontabletten können ohne vorherige Auflösung direkt eingenommen werden.
In Deutschland wird Levomethadon als hochpotentes Schmerzmittel zur Behandlung von starken akuten und chronischen Schmerzen eingesetzt. Das Medikament ist als Lösung zur oralen Anwendung und in Ampullen zur Injektion erhältlich. Eine retrospektive Kohortenstudie bei über 30.000 ausgewerteten Patientendaten hat ergeben, dass das Sterberisiko unter Methadon signifikant höher war als unter Morphin – selbst bei geringen Dosierungen.[52] Nach Ansicht der Autoren sollte daher Methadon nicht als erste Behandlungsoption für nicht-tumorbedingte Schmerzen eingesetzt werden.
Missbrauch und Weitergabe
Für Methadon existiert ein illegaler Markt, da einige Substituierte das Medikament nach der Abgabe durch die Apotheken weiterverkaufen.[53][54] Todesfälle in Zusammenhang mit Methadon erreichten in den USA seit der Jahrtausendwende vierstellige Fallzahlen. Bei Todesfällen mit verschreibungsfähigen opiathaltigen Schmerzmitteln wurde häufig festgestellt, dass die Verstorbenen sich diese ohne Rezept verschafft hatten und dass der Konsum in Kombination mit anderen, illegalen Substanzen erfolgte.[55]
In Österreich und einigen deutschen Substitutionspraxen muss der Patient auch deshalb täglich sein Substitutionsmittel persönlich abholen. Ausnahmen werden in Österreich mit § 23e der Rechtsvorschrift für die Suchtgiftverordnung geregelt.[56]
In Österreich ist eine Weitergabe des Substitutionsmittels Methadon nach dem Suchtmittelgesetz gerichtlich strafbar. Ein Ausschluss aus der Substitutionsbehandlung kann unter anderem erfolgen durch
- Beigebrauch anderer Substanzen, die die Substitutionsbehandlung oder den Gesundheitszustand gefährden,
- die Weitergabe oder intravenöse Anwendung des Substitutionsmittels,
- den widerrechtlichen Handel mit Suchtgiften oder suchtmittelhaltigen Arzneimitteln und
- die missbräuchliche Verwendung von Rezepten.[56]
Handelsnamen |
Monopräparate:
Heptadon (A), Ketalgin (CH), Methaddict, Mephenon (FRA), (L-)Polamidon, Eptadone (D) sowie als Generikum (CH)
Siehe auch |
- Buprenorphin
Ibogain, 18-Methoxycoronaridin
Literatur |
- Hans V. Happel, Frank Männike: Über-Leben mit Methadon. Für eine alternative Drogenpolitik. Konkret Literatur, Hamburg 1992, ISBN 3-89458-116-6.
- U. Honegger, A. Seidenberg: Methadon, Heroin und andere Opioide: Medizinisches Manual für die ambulante opioidgestützte Behandlung. Huber, Bern u. a. 1998, ISBN 3-456-82908-6.
- R. Gerlach, H. Stöver: Vom Tabu zur Normalität – 20 Jahre Substitution in Deutschland. Lambertus, Freiburg i.Br. 2005, ISBN 3-7841-1605-1.
Weblinks |
- Index Methadon-/Substitutionsbehandlung
Methadon. In: Erowid. (englisch)
Methadon in der Onkologie: „Strohhalmfunktion“ ohne Evidenz. Deutsches Ärzteblatt 2017; 114(33-34): A-1530 / B-1298 / C-1269
Methadon gegen Krebs?. Arznei-Telegramm, 2. Juni 2017
Einzelnachweise |
↑ ab Europäische Arzneibuch-Kommission (Hrsg.): Europäische Pharmakopöe 5. Ausgabe. Band 5.0 – 5.7, 2006.
↑ abcde M Kuhnert-Brandstätter, L. Friedl: Beitrag zur thermischen Analyse und zur Polymorphie optischer Antipoden: Pantolacton, Methadon und Usninsäure. Mikrochim. Acta 1979, Vol. 72, S. 97–110, doi:10.1007/BF01198052.
↑ abcd Eintrag zu Methadon in der ChemIDplus-Datenbank der United States National Library of Medicine (NLM).
↑ ab Datenblatt (±)-Methadone hydrochloride bei Sigma-Aldrich, abgerufen am 10. April 2011 (PDF).
↑ ab R. P. Mattick et al.: Methadone maintenance therapy versus no opioid replacement therapy for opioid dependence. (PDF; 369 kB) Cochrane Drugs and Alcohol Group, 2009.
↑ WHO Model List of Essential Medicines. (PDF; 442 kB) abgerufen am 20. September 2012.
↑ Foundation for a Drug-Free World: The Truth About Painkillers. Drug-Free World, S. 16. (eingeschränkte Vorschau in der Google-Buchsuche)
↑ M. Bockmühl, G. Ehrhart: Verfahren zur Darstellung von basischen Estern. Deutsches Reichspatent Nr. 711069, Anmeldedatum: 11. September 1938, Veröffentlichung: 25. September 1941.
↑ P. O. Wolff: On pethidine and methadone derivatives. In: Bulletin of the World Health Organization. Band 2, Nummer 2, 1949, S. 193–204. PMID 15409516. PMC 2553950 (freier Volltext).
↑ C. C. Scott und K. K. Chen: The action of 1,1-diphenyl-1-(dimethylaminoisopropyl)-butanone-2, a potent analgesic agent. In: Federation proceedings. Band 5, Nummer 1, 1946, S. 201. PMID 20983210.
↑ E. M. Stoya: M wie Methadon. In: Die PTA in der Apotheke. 11, 2011, S. 20.
↑ abcd Nicholas Seivewright, assisted by Mark Parry: Community Treatment of Drug Misuse: More Than Methadone. Cambridge University Press, 2009.
↑ A. Ulmer, R. Ullmann: Nachruf Gorm Grimm. (PDF; 292 kB) In: Suchttherapie. 9, 2008, S. 185–186. doi:10.1055/s-0028-1102925.
↑ E. Breitmaier: Alkaloide. Teubner-Verlag, 1997, S. 158.
↑ Merck & Co., US 2 644 010, 1953.
↑ Yutaka Oda, Evan D. Kharasch: Metabolism of Methadone andlevo-α-Acetylmethadol (LAAM) by Human Intestinal Cytochrome P450 3A4 (CYP3A4): Potential Contribution of Intestinal Metabolism to Presystemic Clearance and Bioactivation. In: J Pharmacol Exp Ther. 298(3), Sep 2001, S. 1021–1032. PMID 11504799.
↑ ab Richard P. Mattick et al.: Pharmacotherapies for the Treatment of Opioid Dependence: Efficacy, Cost-Effectiveness and Implementation Guidelines. Informa Healthcare, 2009, ISBN 978-1-84184-400-8.
↑ Stewart B. et al.: When "Enough" is not Enough: New Perspectives on Optimal Methadone Maintenance Dose. (PDF; 95 kB) In: Mount Sinai Journal of Medicine. Volume 67, Number 5 & 6, Oct–Nov 2000, S. 404–411.
↑ E. F. McCance-Katz, P. Jatlow, P. M. Rainey: Effect of cocaine use on methadone pharmacokinetics in humans. In: Am J Addict. 19(1), Jan–Feb 2010, S. 47–52. PMID 20132121.
↑ Elinore F. McCance-Katz: Methadone-Drug Interactions (Medications, illicit drugs, & other substances). (Memento vom 19. Oktober 2013 im Internet Archive) (PDF; 675 kB).
↑ ab Richard A. Rettig, Adam Yarmolinsky, Institute of Medicine (U.S.). Committee on Federal Regulation of Methadone Treatment: Federal regulation of methadone treatment. 1995.
↑ Friesen C (2014) Cell Cycle 13(10):1560-70. Opioid receptor activation triggering downregulation of cAMP improves effectiveness of anti-cancer drugs in treatment of glioblastoma.
↑ Friesen C et al. ( 2013) Oncotarget 4(5):677-90. Cell death sensitization of leukemia cells by opioid receptor activation
↑ Akhila Reddy et al.: Overall Survival among Cancer Patients Undergoing Opioid Rotation to Methadone Compared to Other Opioids. In: Journal of Palliative Medicine. Band 20, Nr. 6, Juni 2017, S. 656–661, doi:10.1089/jpm.2016.0316, PMID 27997283.
↑ Marieke H. J. van den Beuken-van Everdingen, Sander M. J. van Kuijk und Elbert A. Joosten: Response to the Article "Overall Survival among Cancer Patients Undergoing Opioid Rotation to Methadone Compared to Other Opioids". In: Journal of Palliative Medicine. 21. Juli 2017, doi:10.1089/jpm.2017.0301, PMID 28731784.
↑ Philip J. Wiffen et al.: Opioids for cancer-related pain in children and adolescents. In: The Cochrane Database of Systematic Reviews. Band 7, 19. Juli 2017, S. CD012564, doi:10.1002/14651858.CD012564.pub2, PMID 28722116.
↑ S. Mercadante, A. Casuccio und L. Calderone: Rapid switching from morphine to methadone in cancer patients with poor response to morphine. In: Journal of Clinical Oncology: Official Journal of the American Society of Clinical Oncology. Band 17, Nr. 10, Oktober 1999, ISSN 0732-183X, S. 3307–3312, doi:10.1200/JCO.1999.17.10.3307, PMID 10506634.
↑ Nina Buschek: Hirntumor: Methadon verstärkt nicht die Wirksamkeit der Chemotherapie. Abgerufen am 23. Juni 2018.
↑ Methadon bei Krebspatienten: Zweifel an Wirksamkeit und Sicherheit. DGHO, abgerufen am 17. August 2017.
↑ J. Onken et al.: Safety and Tolerance of D,L-Methadone in Combination with Chemotherapy in Patients with Glioma. In: Anticancer Research. Band 37, Nummer 3, 03 2017, S. 1227–1235, doi:10.21873/anticanres.11438, PMID 28314286.
↑ plusminus 16. August 2017daserste.de
↑ ab Felix Hütten: Methadon - Wundermittel gegen Krebs? In: sueddeutsche.de. 24. Juli 2017, ISSN 0174-4917 (sueddeutsche.de [abgerufen am 23. Juni 2018]).
↑ Stellungnahme zur Tumortherapie mit Methadon. (uniklinik-ulm.de [abgerufen am 23. Juni 2018]).
↑ Methadon. Bislang kein Nutzen belegt: Methadon in der Krebsbehandlung. Patienten-Information.de, abgerufen am 29. Januar 2018.
↑ Deutsche Krebshilfe will 5 neue Zentren mit 50 Millionen Euro fördern. In: Deutsches Ärzteblatt. 5. Juli 2017, abgerufen am 29. Januar 2018.
↑ Nina Buschek: Hirntumor: Methadon verstärkt nicht die Wirksamkeit der Chemotherapie. Abgerufen am 30. September 2018.
↑ Dr. Bettina Jung, Apothekerin: Methadon im Zellversuch beim Glioblastom unwirksam. In: DAZ.online. 1. März 2018 (deutsche-apotheker-zeitung.de [abgerufen am 2. Oktober 2018]).
↑ Douglas Goldsmith et al. Methadone Folklore: Beliefs about Side Effects and Their Impact on Treatment. In: Human Organization. 43, 1984, S. 330, doi:10.17730/humo.43.4.64m061v484th3871.
↑ Dana E. Hunt, Douglas S. Lipton, Douglas S. Goldsmith, David L. Strug, Barry Spunt: Substance Use & Misuse. Vol. 20, No. 11–12, 1985, S. 1751–1771, doi:10.3109/10826088509047261
↑ Eric C. Strain et al.: Moderate- vs High-Dose Methadone in the Treatment of Opioid Dependence – A Randomized Trial. In: JAMA. 281, 1999, S. 1000–1005.
↑ Ruthard Stachowske (PDF) Website des Caritasverband Mannheim e. V. Abgerufen am 21. Mai 2014.
↑ J. Stringer, C. Welsh und A. Tommasello: Methadone-associated Q-T interval prolongation and torsades de pointes. In: Am J Health Syst Pharm. 66(9), 1. Mai 2009, S. 825–833. PMID 19386945
↑ QT-Zeit-Screening bei Methadon – US-Leitlinie 2009.
↑ Nicolas Ansermot et al.: Substitution of (R,S)-Methadone by (R)-Methadone – Impact on QTc Interval Clinical Guidelines. In: Archives of Internal Medicine. Vol. 170 No. 6, 22. Mar 2010, S. 529–536.
↑ Stallvik et al.: Corrected QT interval during treatment with methadone and buprenorphine--relation to doses and serum concentrations. Drug And Alcohol Dependence, PMID 23084592
↑ Mori J. Krantz et al.: Clinical Guidelines – QTc Interval Screening in Methadone Treatment. In: Annals of Internal Medicine. vol. 150 no. 6, 17. Mar 2009, S. 387–395.
↑ Mori J. Krantz et al.: Concerns About Consensus Guidelines for QTc Interval Screening in Methadone Treatment. In: Ann Intern Med. 151, 2009, S. 218–219. PMID 19652193
↑ ab E. Freye: Opioide in der Medizin. 8. Auflage. Springer, 2010, ISBN 978-3-540-88796-6.
↑ Michael Krausz, Christian Haasen und Dieter Naber: Pharmakotherapie der Sucht. Karger Medical and Scientific Publishers, 2003, ISBN 3-8055-7482-7.
↑ ab Felix Tretter und Max Braun: Suchtmedizin kompakt: Suchtkrankheiten in Klinik und Praxis; mit 51 Tabellen. Schattauer Verlag, 2008, ISBN 978-3-7945-2611-6, S. 213.
↑ Karlheinz Keppler und Heino Stöver: Gefängnismedizin: Medizinische Versorgung unter Haftbedingungen. Georg Thieme Verlag, 2009, ISBN 978-3-13-157001-7.
↑ Wayne A. Ray et al.: Out-of-hospital mortality among patients receiving methadone for noncancer pain. In: JAMA internal medicine. Band 175, Nr. 3, März 2015, S. 420–427, doi:10.1001/jamainternmed.2014.6294, PMID 25599329, PMC 4346542 (freier Volltext).
↑ W. R. Davis, B. D. Johnson: Prescription opioid use, misuse, and diversion among street drug users in New York City. In: Drug and alcohol dependence. Band 92, Nummer 1–3, Januar 2008, S. 267–276, doi:10.1016/j.drugalcdep.2007.08.008. PMID 17913395. PMC 2317747 (freier Volltext).
↑ Metha-Spritz-Umfrage (PDF) akzept.org
↑ National Prescription Drug Threat Assessment. (PDF) National Drug Intelligence Center, USA, April 2009. Seiten 23–24. (PDF; 3,1 MB)
↑ ab Rechtsvorschrift für Suchtgiftverordnung in Österreich. Fassung vom 16. Dezember 2009 (mit Behandlungsvertrag).
| Dieser Artikel behandelt ein Gesundheitsthema. Er dient nicht der Selbstdiagnose und ersetzt keine Arztdiagnose. Bitte hierzu den Hinweis zu Gesundheitsthemen beachten! |




